- Home »
- 研究内容 »
- Research
Research
二百以上の細胞種から構成されるヒトの体ーその病気の原因や治療法を探索するために、分子細胞組織学的方法により細胞の型を同定し、細胞の機能分化のメカニズムを解明しています。また、組織再生・リモデリングの基礎的・応用的研究を行っています。
1. 新規オプシン発現細胞の機能と発生分化の研究
 脊椎動物の眼の網膜は形態的、機能的に多様な細胞から成り、細胞分化を研究するよいモデル系です。哺乳類の網膜には50種類以上の細胞型がありますが、網膜細胞の形態と機能の分化を決める詳細なメカニズムについては解明されていません。最近われわれは、機能が未知の視物質オプシン様蛋白質が古典的視細胞以外の網膜や脳などの少数の神経細胞集団に存在することを明らかにしました。これは、新しい光受容細胞が神経系に存在することを示唆しています。本研究では、オプシン5などの生体内での機能を明らかにするとともに、これら光受容蛋白質遺伝子の発現制御機構を明らかにすることで、細胞分化の基本的なしくみを解明していきます。現在私たちは繁殖が容易で脳へ光が浸透しやすいメダカをモデル動物とし、ゲノム編集法によって遺伝子改変動物を作出して解析を行うことで、オプシン5の生理機能や発現制御機構にアプローチしています。
脊椎動物の眼の網膜は形態的、機能的に多様な細胞から成り、細胞分化を研究するよいモデル系です。哺乳類の網膜には50種類以上の細胞型がありますが、網膜細胞の形態と機能の分化を決める詳細なメカニズムについては解明されていません。最近われわれは、機能が未知の視物質オプシン様蛋白質が古典的視細胞以外の網膜や脳などの少数の神経細胞集団に存在することを明らかにしました。これは、新しい光受容細胞が神経系に存在することを示唆しています。本研究では、オプシン5などの生体内での機能を明らかにするとともに、これら光受容蛋白質遺伝子の発現制御機構を明らかにすることで、細胞分化の基本的なしくみを解明していきます。現在私たちは繁殖が容易で脳へ光が浸透しやすいメダカをモデル動物とし、ゲノム編集法によって遺伝子改変動物を作出して解析を行うことで、オプシン5の生理機能や発現制御機構にアプローチしています。
参考論文:
- Two UV-Sensitive Photoreceptor Proteins, Opn5m and Opn5m2 in Ray-Finned Fish with Distinct Molecular Properties and Broad Distribution in the Retina and Brain. Sato K, Yamashita T, Haruki Y, Ohuchi H, Kinoshita M, Shichida Y. PLoS One. 2016 May 11;11(5):e0155339. doi: 10.1371/journal.pone.0155339.
- Evolution of Mammalian Opn5 as a Specialized UV-absorbing Pigment by a Single Amino Acid Mutation. Yamashita T, Ono K, Ohuchi H, Yumoto A, Gotoh H, Tomonari S, Sakai K, Fujita H, Imamoto Y, Noji S, Nakamura K, Shichida Y. J Biol Chem. 2014 Feb 14;289(7):3991-4000. doi: 10.1074/jbc.M113.
- A non-mammalian type opsin 5 functions dually in the photoreceptive and non-photoreceptive organs of birds. Ohuchi H, Yamashita T, Tomonari S, Fujita-Yanagibayashi S, Sakai K, Noji S, Shichida Y. PLoS One. 2012;7(2):e31534.
- Opn5 is a UV-sensitive bistable pigment that couples with Gi subtype of G protein. Yamashita T, Ohuchi H, Tomonari S, Ikeda K, Sakai K, Shichida Y. Proc Natl Acad Sci U S A. 2010 Dec 21;107(51):22084-9.
- Expression patterns of the opsin 5-related genes in the developing chicken retina. Tomonari S, Migita K, Takagi A, Noji S, Ohuchi H. Dev Dyn. 2008 Jul;237(7):1910-22.
2.眼胞のパターン形成と形態形成の研究
 網膜は、多様な網膜神経細胞の存在する神経網膜 (NR) と網膜色素上皮 (RPE) とから成り、細胞分化のしくみを明らかにするよいモデル系です。NR とRPEは発生学的に、それぞれ眼杯の内層と外層とに由来する進化的に保存された網膜領域で、発生初期の眼胞期に2つの領域が分化します。この領域分化には、眼胞周囲からの細胞外分泌性シグナルの作用が重要であると考えられていましたが、最近の研究で、眼胞の神経上皮自律的なしくみで進行することがわかってきました。我々は、予定RPEに作用してNRに分化方向を変換させる働きのある転写因子Lhx1に着目し、網膜幹細胞と遺伝子発現が類似しているNRを誘導する分子機構について明らかにしようとしています。
網膜は、多様な網膜神経細胞の存在する神経網膜 (NR) と網膜色素上皮 (RPE) とから成り、細胞分化のしくみを明らかにするよいモデル系です。NR とRPEは発生学的に、それぞれ眼杯の内層と外層とに由来する進化的に保存された網膜領域で、発生初期の眼胞期に2つの領域が分化します。この領域分化には、眼胞周囲からの細胞外分泌性シグナルの作用が重要であると考えられていましたが、最近の研究で、眼胞の神経上皮自律的なしくみで進行することがわかってきました。我々は、予定RPEに作用してNRに分化方向を変換させる働きのある転写因子Lhx1に着目し、網膜幹細胞と遺伝子発現が類似しているNRを誘導する分子機構について明らかにしようとしています。
参考論文:
- Autopsy Case of Bilateral Optic Nerve Aplasia with Microphthalmia: Neural Retina Formation Is Required for the Coordinated Development of Ocular Tissues. Ohuchi H, Taniguchi K, Miyaishi S, Kono H, Fujita H, Bando T, Fuchizawa C, Ohtani Y, Ohtani O. Acta Med Okayama. 2016 Apr;70(2):131-137.
- The expression of LIM-homeobox genes, Lhx1 and Lhx5, in the forebrain is essential for neural retina differentiation. Inoue J, Ueda Y, Bando T, Mito T, Noji S, Ohuchi H. Dev Growth Differ. 2013 Sep;55(7):668-75. doi: 10.1111/dgd.12074.
- Molecular aspects of eye evolution and development: from the origin of retinal cells to the future of regenerative medicine. Ohuchi H. Acta Med Okayama. 2013 Aug;67(4):203-12. Review.
- Lhx1 in the proximal region of the optic vesicle permits neural retina development in the chicken. Kawaue T, Okamoto M, Matsuyo A, Inoue J, Ueda Y, Tomonari S, Noji S, Ohuchi H. Biol Open. 2012 Nov 15;1(11):1083-93.
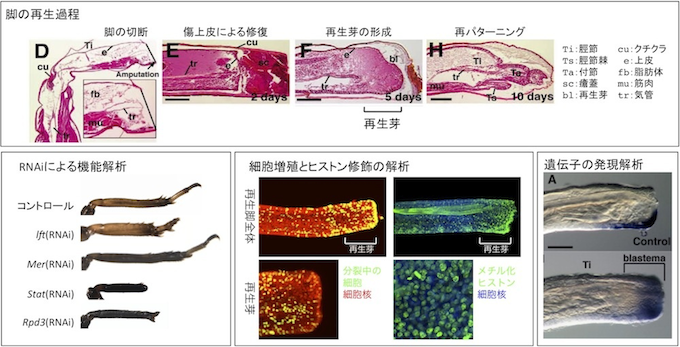
3. 新しいモデル昆虫(コオロギ)を用いた再生の分子機構の解明
ヒトやマウス、ニワトリなど高等脊椎動物では器官再生は限られた時期、組織でしか見られませんが、コオロギなどの不完全変態昆虫では触角や脚が切断されても完全に再生することができます。ヒトとコオロギは全く違う生き物ですが遺伝子の多くは共通であり、コオロギが新しい遺伝子を獲得することで再生が可能な生物へと進化したわけではありません。コオロギの脚再生を制御する分子メカニズムを明らかにし、得られた知見をヒトやマウスにフィードバックすることで高等脊椎動物の器官再生の可能性を探ります。
参考論文:
- 昆虫に学ぶ器官再生 板東哲哉ら ケミカルタイムズ 2016 (3): 2-6.
- Leg regeneration is epigenetically regulated by histone H3K27 methylation in the cricket Gryllus bimaculatus. Hamada Y, Bando T, Nakamura T, Ishimaru Y, Mito T, Noji S, Tomioka K, Ohuchi H. Development. 2015 Sep 1;142(17):2916-2927.
- コオロギ脚再生の分子メカニズム 板東哲哉ら 実験医学 2014 Jan; 32 (1):15-21.
- Analysis of RNA-Seq data reveals involvement of the JAK/STAT signalling during leg regeneration of the cricket Gryllus bimaculatus. Bando T, Ishimaru Y, Kida T, Hamada Y, Matsuoka Y, Nakamura T, Ohuchi H, Noji S, Mito T. Development. 2013 Mar; 140(5):959-64.
- Lowfat, a mammalian Lix1 homologue, regulates leg size and growth under the Dachsous/Fat signaling pathway during tissue regeneration. Bando T, Hamada Y, Kurita K, Nakamura T, Mito T, Ohuchi H, Noji S. Dev Dyn. 2011 Jun;240(6):1440-53
- Regulation of leg size and shape by the Dachsous/Fat signalling pathway during regeneration. Bando T, Mito T, Maeda Y, Nakamura T, Ito F, Watanabe T, Ohuchi H, Noji S. Development. 2009 Jul;136(13):2235-45.
4. 骨形成や骨吸収を調節する新規分子の探索
 私たちの骨は、絶えず代謝しています。これを骨代謝と言います。骨芽細胞は骨をつくる役割を、破骨細胞は骨を溶かす役割を持っており、骨代謝において中心的な役割を担っています。これらの細胞の機能的異常は、骨粗鬆症、骨形成不全、関節リウマチや骨髄炎などの炎症による骨溶解、といった疾患や病態の原因となっています。そしてこれらの疾患は、未だ十分な治療法が開発されていません。私たちは、生体内における細胞死や活性酸素の関与を解析してきました。そして、骨代謝や骨関連疾患におけるこれらの関与を研究しています。また一方で、骨代謝を調節する新規分子の探索を行っています。これらの研究で得られた成果を骨関連疾患の治療に結びつけたいと考えています。
私たちの骨は、絶えず代謝しています。これを骨代謝と言います。骨芽細胞は骨をつくる役割を、破骨細胞は骨を溶かす役割を持っており、骨代謝において中心的な役割を担っています。これらの細胞の機能的異常は、骨粗鬆症、骨形成不全、関節リウマチや骨髄炎などの炎症による骨溶解、といった疾患や病態の原因となっています。そしてこれらの疾患は、未だ十分な治療法が開発されていません。私たちは、生体内における細胞死や活性酸素の関与を解析してきました。そして、骨代謝や骨関連疾患におけるこれらの関与を研究しています。また一方で、骨代謝を調節する新規分子の探索を行っています。これらの研究で得られた成果を骨関連疾患の治療に結びつけたいと考えています。
参考論文:
- Effect of risedronate on osteoblast differentiation, expression of receptor activator of NF-κB ligand and apoptosis in mesenchymal stem cells. Fujita H, Kurokawa K, Ogino T, Ono M, Yamamoto M, Oka T, Nakanishi T, Kobayashi N, Tanaka N, Ogawa T, Suzaki E, Utsumi K, Sasaki J. Basic Clin Pharmacol Toxicol. 2011 Aug;109(2):78-84.
- Alpha-tocopheryl succinate induces rapid and reversible phosphatidylserine externalization in histiocytic lymphoma through the caspase-independent pathway. Fujita H, Shiva D, Utsumi T, Ogino T, Ogawa T, Abe K, Yasuda T, Utsumi K, Sasaki J. Mol Cell Biochem. 2010 Jan;333(1-2):137-49.
- Alpha-lipoic acid suppresses 6-hydroxydopamine-induced ROS generation and apoptosis through the stimulation of glutathione synthesis but not by the expression of heme oxygenase-1. Fujita H, Shiosaka M, Ogino T, Okimura Y, Utsumi T, Sato EF, Akagi R, Inoue M, Utsumi K, Sasaki J. Brain Res. 2008 Apr 24;1206:1-12.
- Involvement of Ras/extracellular signal-regulated kinase, but not Akt pathway in risedronate-induced apoptosis of U937 cells and its suppression by cytochalasin B. Fujita H, Utsumi T, Muranaka S, Ogino T, Yano H, Akiyama J, Yasuda T, Utsumi K. Biochem Pharmacol. 2005 Jun 15;69(12):1773-84.