
三重中学校・三重高等学校出身
大阪大学工学部卒業
大阪大学大学院工学研究科博士前期課程修了
広島大学大学院理学研究科博士後期課程修了
(2年にて早期修了、 博士(理学))
日本学術振興会博士研究員(PD)大阪大学産業科学研究所
岡山大学自然科学研究科 非常勤講師
岡山大学医学部助手
岡山大学大学院医歯薬学総合研究科 助手
岡山大学大学院医歯薬学総合研究科 講師
岡山大学大学院医歯薬学総合研究科 准教授(研究教授)
工学部でしたが、生命科学に興味がありました。4年生の卒業研究と大学院は大阪大学産業科学研究所でお世話になりました。当時研究室を主宰されていた二井将光教授(大阪大学名誉教授)の元で生化学研究のおもしろさと厳しさを教わりました。
研究職志望で修士課程修了後は博士課程進学を考えていました。最終的に就職活動をして、化粧品会社の研究所に就職しました。会社の仕組みはもとより、商品のコンセプトの創製からマーケティングまで学ぶことができ楽しかったです。しばらくして、それまで寝ていた生命科学研究心が目覚め、大学に戻り博士号を取得し今日に至ります。
私は、これまで工学、薬学、理学、現在は医学部に所属し、多様な学部を経験し、また多様な学生さんを指導でき貴重な経験をうることが出来ました。企業時代の経験と共に、これらすべて大変貴重な経験だと思っています。
将来ぼんやりとでも研究職を目指す学生さんをはじめ修士課程入学希望の学生さんには、様子などよくわかりますので、研究はもとより、研究以外でも、なんでも相談させていただければと思います。
ダイナミンは、分子量が約80−100kDaのタンパクです。また、ダイナミンは、GTPを加水分解する酵素であり、哺乳類細胞のエンドサイトーシスやミトコンドリアの分裂等において、GTPの加水分解と共役したタンパクの構造変化により膜を切断し小胞化したり、ミトコンドリア膜を分裂します。この機構がゆえにダイナミンは、メカノエンザイムと呼ばれています。しかし、ダイナミンの時空間的な動態は、ほとんどわかっていません。私たちは、透過電子顕微鏡、クライオ電子顕微鏡、高速原子間力顕微鏡を駆使してこのメカニズムの解明を目指しています。
神経細胞は、長い神経突起を介し細胞間でシナプスを形成して情報を伝達しています。神経突起形成の分子機構を解明することは、神経機能はもとより神経再生の基本原理の理解に重要です。将来シナプスを形成する神経突起先端部では、成長円錐(growth cone)が作られます。成長円錐では、細長い突起をのばし、周囲の環境を察知してその方向を決めていきます。私たちは、成長円錐でのアクチンダイナミクスに注目して、その制御機構を解析しています。これまでに、アクチン線維の形成や安定性を促進する新規メカニズムを見つけています(Yamada et al., MBC, 2007; JBC, 2009; J. Neurosci, 2013; Int J Oncol, 2016)。私たちの対象としているタンパクは、空間認知、学習能力に重要であることが示唆されており、私たちの研究が脳の高次機能の解明につながっていくものと考えています。
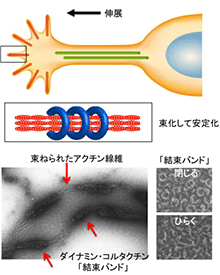
Yamada et al., J. Neurosci., 2013
これら一部の業績は、山陽新聞、毎日新聞、読売新聞、中国新聞、朝日新聞(以上岡山、中国版)、朝日新聞(関西版夕刊)に2007年10-12月及び山陽新聞、読売新聞(岡山版)に2013年4月に掲載されました。また、山陽放送イブニングニュース(2007年11月6日)においてトップニュースで紹介されました。
腎臓は、生体内から老廃物を除去したり、水分・電解質など体内環境の調整、造血ホルモンの合成等を行っており、とても大事な器官です。腎臓の機能破綻は、直ちに生命の維持が困難になります。腎臓病が年月を重ね慢性化し、最終的に腎臓の機能不全から透析に移行すると患者さんのQOLの低下、さらに医療経済的にも負担が大きいと考えられます。腎臓の機能で、最も重要なものに、血液のろ過機能があります。血液は、腎臓の糸球体の中を通過する間に、老廃物などが除去され、老廃物は尿と共に体外に排出されます。糸球体では、ポドサイト(たこ足細胞)が毛細血管を取り巻き、基底膜と共に自身がスリット膜というフィルターを形成し、血液ろ過に働いています。ポドサイトの機能不全は、このろ過機能の破綻につながりますので、いかにポドサイトの機能を維持させるのかが重要です。
私たちは、腎・免疫・内分泌代謝内科学講座と協力して、このポドサイトがどのようにフィルターを形成するのか?周りの細胞とどのようにコミュニケーションを行って、ろ過機能を発揮するのか?また、先天性遺伝病に関わる腎炎について、ダイナミン関連タンパクを中心に解析しています。
シャルコー・マリー・トゥース病(Charcot-Marie-Tooth)は、遺伝性運動性感覚性末梢神経障害を示す先天性遺伝疾患です。末梢神経が変性していくことにより、四肢の運動と感覚が徐々に障害されていきます。主に、下肢の遠位部で筋力の低下がおこり、つまづきなど歩行障害がおきます。10万人に17−40人の有病率です。 原因遺伝子は、いくつか報告されています。ダイナミンが原因遺伝子の1つであることが、2005年に報告されました(Zuchner et al., Nature Genetics, 2005). しかしながら、ダイナミンがどのようにこの病態に関わるのかは未だ不明な点が多いです。私たちは、ダイナミンと細胞骨格に着目してその解析を行っており、ダイナミンのアクチン制御の破綻が病態発症の一因であることを発見しました(Yamada et al., Neurosci lett, 2016)。
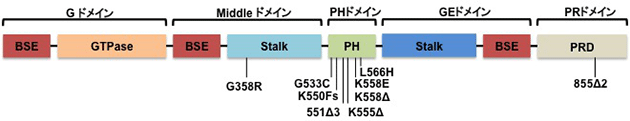
図:これまでに報告されたダイナミンのCMT変異
がん細胞は、局部で腫瘍を形成しながら、ときに移動し浸潤して他組織に転移していきます。このがん細胞の浸潤、転移は、がんの悪化につながります。私たちは、ダイナミンががん細胞の浸潤、転移に必要であることを見つけました(Yamada et al.,BBRC, 2009)。ダイナミンの機能阻害は、効率的にがん細胞の移動を抑制します。この知見を元に、制がん作用を持つダイナミン阻害剤分子を in vitro 及び in vivo で 見つけました(特許第5283962, 医薬組成物; 特許第5806168, 抗浸潤薬の新規スクリーニング法;特願5922563, 抗がん剤; Yamada et al., BBRC, 2014)。
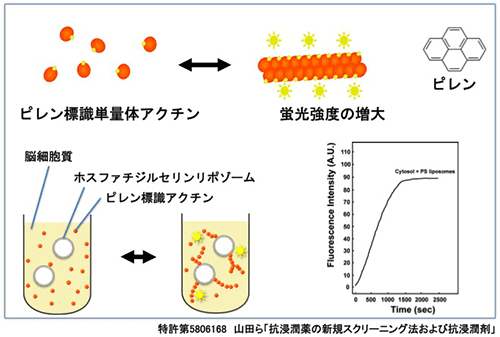
図:新規に開発した抗浸潤剤スクリーニング法
制がん剤をスクリーニングする過程で、これまで臨床において”がんの治療以外”で使用されてきた脳内作動薬が、強力に脳腫瘍細胞の浸潤及び腫瘍の増大を抑制することを発見しました。脳腫瘍は、その発症部位と、また血液脳関門のために抗がん剤が脳内患部に届きにくいこともあり、治療が難しいことが多いです。私たちの発見により、治療法の選択が大きく広がることが期待されます。
このような、薬剤の新たな効能を見いだすことを”ドラッグリポジショニング”と言います。これら薬剤は、これまで使用され副作用など安全性に関しても蓄積されたデーターがあり、創薬に関する時間とコストが、新規に創薬するよりも大幅に短縮できます。
マラリア感染症は世界3大感染症の一つであり感染者数約5億人,犠牲者数年間約100万人とその被害は非常に大きいものになっています。ヒトに感染するマラリア原虫のうち、最も症状が重篤で死亡率の高い熱帯熱マラリアの原因である原虫のヒト赤血球における寄生機構に関するダイナミン関連分子の役割について研究しています。マラリア原虫は、赤血球に侵入する際に寄生胞膜と呼ばれる複雑な構造をした膜でできた袋を形成し、その中で生存します。このため、マラリア原虫は、原虫細胞膜、寄生胞膜、赤血球膜を含む膜構造によって宿主免疫系の攻撃からを受けにくくなっています。これら膜間での栄養物質やタンパク、低分子の物質輸送には膜を介した小胞輸送が深く関与していると考えられていますが、その詳細は不明です。ダイナミン関連分子の膜の形態制御の解析から、小胞輸送機構の全貌を解明したく思っています。これら膜の形成阻害は、原虫の生存に直接関わると考えられ、これら関連分子を標的とした抗マラリア薬が期待されます。
最近の研究業績等は山田のResearchmapのページをご覧下さい。
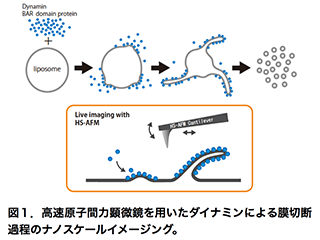
エンドサイトーシスは、細胞が外界から物質を取り込む仕組みであり、細胞分化、神経伝達、シグナル伝達など、多様な生命現象において重要な役割を担います。エンドサイトーシスの異常は、神経疾患や筋疾患などの原因にもなることから、その機構解明は医学的な重要性も持ちます。エンドサイトーシスでは、細胞膜の限られた領域が陥入し切断されます。この際にGTP加水分解酵素であるダイナミンが、膜の切断部分にらせん状に巻きつき、GTPの加水分解に共役して、膜を「ひねり切る」(Pinchase)あるいは「ちぎり切る」(Poppase)と考えられています。しかし、ダイナミンによる膜切断機構の実態は未だに明らかになっていません。私たちは、ダイナミンによる膜切断過程をin vitroで再現し、その動態を高速原子間力顕微鏡(高速AFM)で観察することで、エンドサイトーシスにおける膜切断機構を明らかにしようとしています(図1)。
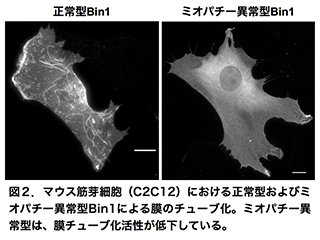
先天性ミオパチーは、骨格筋の先天的な構造異常によって、筋力や筋緊張の低下や呼吸障害などを起こす疾患で、厚生労働省より難病指定を受けています。先天性ミオパチーの一つである中心核ミオパチー(Centronuclear myopathy)は、ダイナミン(Dynamin2)およびアンフィファイジン(Amphiphysin2)がその原因遺伝子になっていることが明らかになっています。ダイナミンとアンフィファイジンは、エンドサイトーシスにおける膜の切断と変形(膜リモデリング)を行うことから、膜リモデリングの異常がミオパチー発症を引き起こす原因であると考えられています。そこで私たちは、筋細胞分化系と試験管内再構成系を用い、ダイナミンおよびアンフィファイジンの機能阻害実験や各種イメージング技術を組み合わせた多角的なアプローチにより、先天性ミオパチーの発症機構を明らかにしようとしています(図2)。
細胞質分裂(Cytokinesis)は、有糸分裂(Mitosis)や減数分裂(Meiosis)によって分離した染色体を、娘細胞に均等に分配する重要な役割を果たします。そのため細胞質分裂の異常は、ガンや不妊、発生異常などの原因になります。細胞質分裂では、ダイナミックな細胞の形態変化が起こりますが、その仕組みはあまり理解されていません。私は、細胞膜の変形や切断(膜リモデリング)に必要なBARスーパーファミリー蛋白質やESCRT複合体が、細胞質分裂に必須の機能をもつことを明らかにしてきました(Takeda et al., Nat. Cell Biol. 2004; Takeda et al., Open Biol. 2013; Capalbo et al., Open Biol. 2012)。私たちは、細胞生物学、in vitro再構成系、ライブイメージングなどの多角的アプローチを用い、細胞質分裂における膜リモデリングの作用機序やその調節機構を明らかにしていきます(図3)。

最近の研究業績はResearchmapをご覧くださいメールまたは電話にて御相談下さい。詳しくは募集要項のページをご覧下さい。
Takeda, T., Robinson, I.M., Savoian, M.M., Griffiths, J.R., Whetton, A.D., McMahon, H.T. and Glover, D.M. (2013) Drosophila F-BAR protein Syndapin contributes to coupling the plasma membrane and contractile ring in Cytokinesis. Open Biol. 7;3(8):130081. (インタビューはこちら http://rsob.royalsocietypublishing.org/content/3/8/130081/suppl/DC2)
Capalbo, L. Montembault, E., Takeda, T., Bassi, ZI., Glover, D.M., D’Avino, P.P. (2012) The chromosomal passenger complex controls the function of endosomal sorting complex required for transport-III Snf7 proteins during cytokinesis. Open Biol. 2(5):120070.
Takeda, T., Chang, F. (2005) Role of fission yeast myosin I in organization of sterol-rich membrane domains. Curr Biol. 15(14):1331-6.
Takeda, T., Kawate, T., Chang, F. (2004) Organization of a sterol-rich membrane domain by Cdc15p during cytokinesis in fission yeast. Nat Cell Biol. 6(11):1142-4.
竹田 哲也(2016)細胞質分裂における膜ダイナミクスの機能、生物物理 56 (1), 013-017.
D’Avino, P.P., Takeda, T., Capalbo, L., Zhang, W., Lilley, K., Laue, E. and Glover, D.M. (2008) Interaction between Anillin and RacGAP50C connects the actomyosin contractile ring with spindle microtubules at the cell division site. J. Cell Sci. 121(Pt 8):1151-8.
Glover, D.M., Capalbo, L., D'Avino, P.P., Gatt, M.K., Savoian, M.S. and Takeda, T. (2008) Girds ‘n’ Cleeks o’ Cytokinesis: microtubule sticks and contractile hoops in Drosophila cell division. Biochem Soc Trans. 2008 Jun;36(Pt 3):400-4.
Yonetani, A, Lustig, RJ., Moseley, J., Takeda, T., Goode, BL. and Chang, F. (2008) Regulation and targeting of the fission yeast formin cdc12p in cytokinesis. Mol. Biol. Cell 2008 May;19(5):2208-19.
Noguchi E, Iwama A, Takeda K, Takeda T, Kamioka M, Ichikawa K, Akiba T, Arinami T, Shibasaki M. (2003) The promoter polymorphism in the eosinophil cationic protein gene and its influence on the serum eosinophil cationic protein level. Am J Respir Crit Care Med., 167(2):180-4.
Ueno H, Gonda K, Takeda, T., Numata O. (2003) Identification of elongation factor-1alpha as a Ca2+/calmodulin-binding protein in Tetrahymena cilia. Cell Motil Cytoskeleton. 55(1):51-60.
Takeda, T., Yoshihama, I., Numata, O. (2001) Identification of Tetrahymena Hsp60 as a 14-nm Filament Protein/Citrate Synthase-Binding Protein and Its Possible Involvement in the Oral Apparatus Formation. Genes to Cells 6 (2), 132-149.
Numata, O., Hanyu, K., Takeda, T., Watanabe, Y. (1998) Tetrahymena calcium-binding proteins, TCBP-23 and TCBP-25. In Tetrahymena thermophila, ed. By D.J. Asai and J.D. Forney, Methods in Cell Biology 62, 455-465.
Takeda, T., Watanabe, Y., Numata, O. (1997) Direct Demonstration of the Bifunctional Property of Tetrahymena 14-nm Filament Protein/Citrate Synthase Following Expression of the Gene in Escherichia coli. Biochem.Biophis.Res.Commun. 237, 205-210.
Takeda, T., Kurasawa, Y., Watanabe, Y., Numata, O. (1995) Polymerization of Highly Purified Tetrahymena 14-nm Filament Protein/Citrate Synthase into Filaments and Its Possible Role in Regulation of Enzymatic Activity. J.Biochemistry 117, 869-874.