蛋白質アクチンの高分解能構造とATP加水分解反応メカニズムの解明~地球上の生命の最も重要な化学反応の一つの理解の前進~
2022年10月20日
東海国立大学機構
名古屋大学
広島大学
岡山大学
広島市立大学
東海学院大学
横浜市立大学
長岡技術科学大学
九州工業大学
東京薬科大学
豊田理化学研究所
あいちシンクロトロン光センター
◆発表のポイント
- 蛋白質アクチンのF型の高分解能構造を解明。
- それら構造を基に量子化学の計算法を使ってATP加水分解反応注1)のメカニズムを解明。
- 地球上の生命維持にとって最も重要な化学反応の一つであるATP加水分解反応の共通メカニズムの理解を大きく進めた。
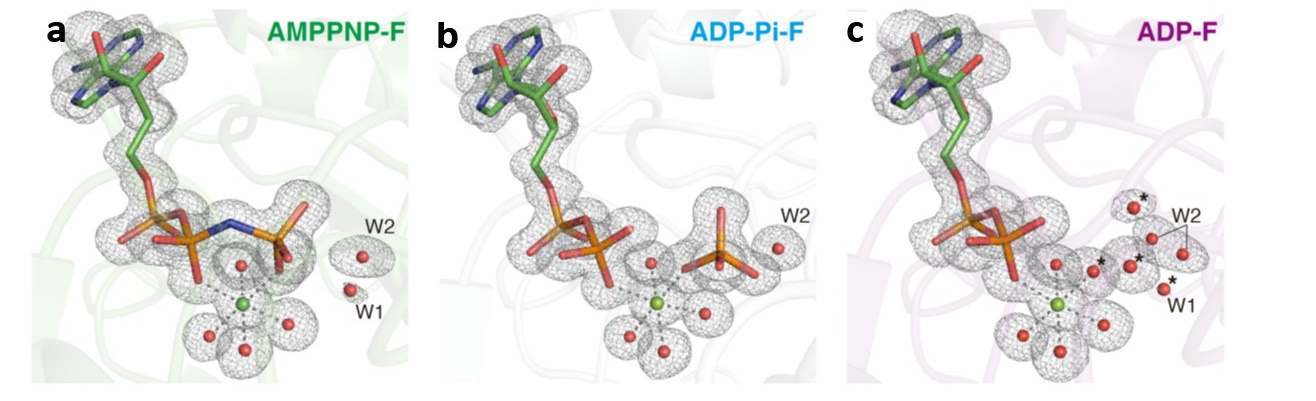
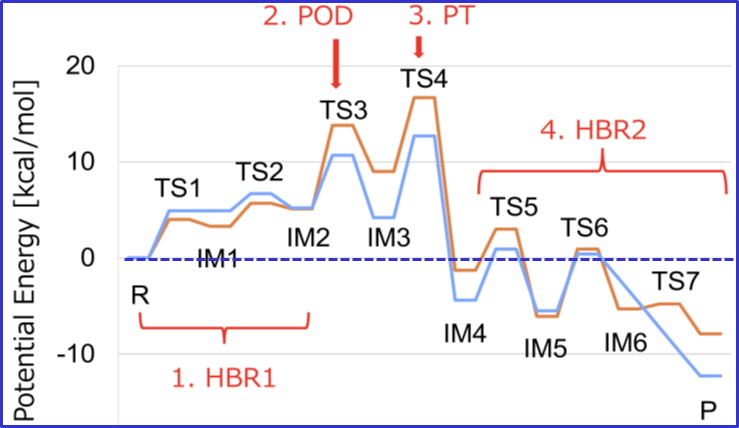
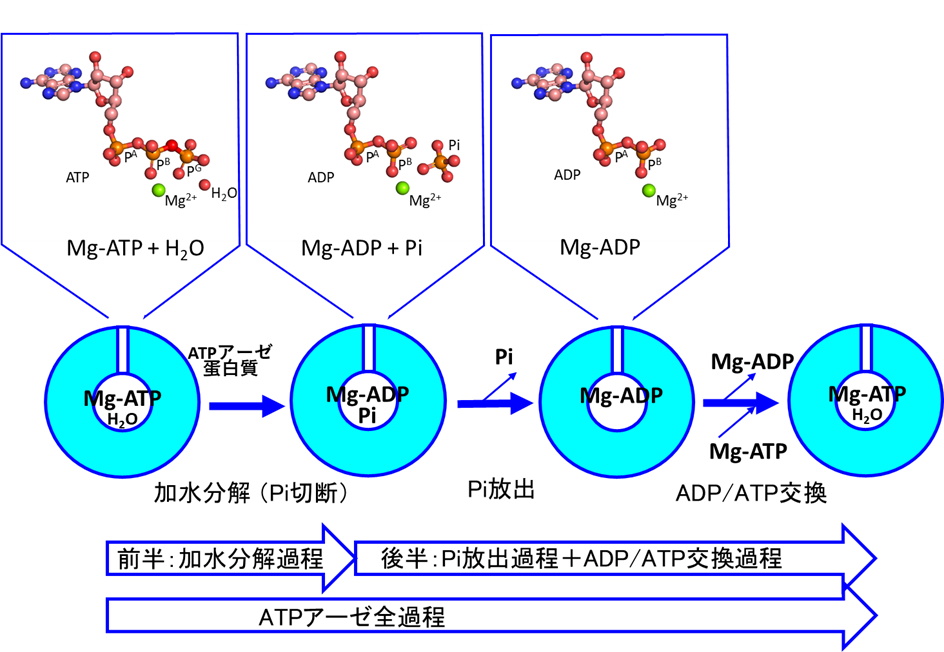
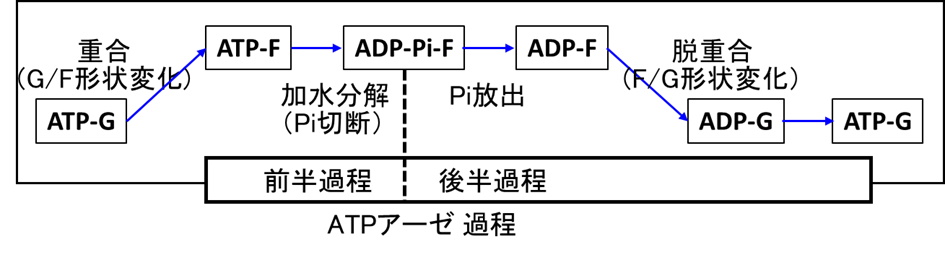
国立大学法人東海国立大学機構 名古屋大学大学院理学研究科の前田 雄一郎 特任教授(研究当時。現在は、名古屋大学大学院情報学研究科客員教授)、国立大学法人広島大学大学院先進理工系科学研究科の兼松 佑典 助教、および国立大学法人岡山大学異分野基礎科学研究所の武田 修一 特任助教を中心とした研究チームは、蛋白質F型アクチンの1.15 Å 分解能の結晶構造を得て、それに基づき量子化学計算法であるQM/MM計算法を用いて、ATP加水分解反応のメカニズムを解明しました。ATPは地球上の生命のエネルギー通貨です。ATPの化学エネルギーは、ATPアーゼ蛋白質と呼ばれる多くの蛋白質によって、力学的仕事や情報に変換され、種々の細胞機能の発現に利用されますが、蛋白質分子の構造情報の不足によりそのメカニズムはよくわかっていませんでした。本研究では、F型アクチンの構造を反応の始状態と終状態の双方で、他のいかなるATPアーゼ蛋白質で得られていた構造情報より高精細な1.15 Åという高分解能で得て、この問題を解決しました。解明されたATP加水分解反応メカニズムは、これまで提案されていた反応モデルと基本的に一致し、地球上のATPアーゼ蛋白質が共通のメカニズムで働くことを強く示唆します。
今回解明されたのはATPアーゼ過程全体の前半部分(加水分解反応過程)のみであり、後半部分(Pi解離過程)は、未解明です。今後はPi解離過程の研究が進むことが期待されます。
本研究成果は、2022年10月18日付アメリカ科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版に掲載されました。
■論文情報
雑誌名:Proceedings of the National Academy of Sciences of the USA
(米国科学アカデミー紀要)
論文タイトル:”Structures and Mechanisms of the actin ATP hydrolysis”
著者:
前田 雄一郎(まえだ・ゆういちろう)名古屋大学大学院・情報学研究科、客員教授
兼松 佑典(かねまつ・ゆうすけ)広島大学・大学院先進理工系科学研究科、助教
武田 修一(たけだ・しゅういち)岡山大学異分野基礎科学研究所、特任助教
成田哲博(なりた・あきひろ)名古屋大学大学院・理学研究科・生命理学専攻、准教授
小田俊郎(おだ・としろう) 東海学院大学・健康福祉学部・総合福祉学科、教授
小池亮太郎(こいけ・りょうたろう)名古屋大学大学院・情報学研究科・複雑系科学専攻、助教
太田元規(おおた・もとのり)名古屋大学大学院・情報学研究科・複雑系科学専攻、教授
鷹野優(たかの・ゆう)広島市立大学大学院・情報科学研究科・医用情報科学専攻、教授
森次圭(もりつぐ・けい)横浜市立大学・生命医科学研究科、特任准教授
藤原郁子(ふじわら・いくこ)長岡技術科学大学・技学研究院・物質生物系、准教授
田中康太郎(たなか・こうたろう)名古屋大学大学院・細胞生理学研究センター・構造生理学分野、助教
小松英幸(こまつ・ひでゆき)九州工業大学・大学院情報工学研究院 ・生命化学情報工学研究系、准教授
永江峰幸(ながえ・たかゆき)東京薬科大学・薬学部・医療衛生薬学科、助教
故渡邉信久(わたなべ・のぶひさ)名古屋大学・シンクロトロン光研究センター、教授 (2019.3.26没)
岩佐充貞(いわさ・みつさだ)名古屋大学大学院・情報学研究科・複雑系科学専攻、協力研究員
DOI: 10.1073/pnas.2122641119
URL: https://www.pnas.org/doi/10.1073/pnas.2122641119
【研究資金】
本研究は、日本学術振興会・科学研究費補助金(科研費)、日本医療研究開発機構(AMED)、豊田理化学研究所、武田科学振興財団、大幸財団、アクチン研究会の支援のもとで行われたものです。
<詳しい研究内容について>
蛋白質アクチンの高分解能構造とATP加水分解反応メカニズムの解明~地球上の生命の最も重要な化学反応の一つの理解の前進~