
- TOKUMITSU & OHTSUKA
Group - MAGARI
Group
-
Background
数十兆の細胞からなる私たち人間は、その生体の恒常性を維持するために正常な細胞反応、細胞応答を必要とします。この正常な細胞機能の形成には細胞内に存在する様々な生体分子が多様な分子間ネットワークを駆使して時間的、空間的に正確に制御されなければなりません。この細胞内分子群の化学的、物理的相互作用を細胞内シグナル伝達と呼びます。したがって、この細胞内シグナル伝達機構の先天的、後天的な破綻は細胞機能の齟齬をきたし、結果として“がん”や“メタボリック症候群”など多くの疾患の原因になることが知られています。世界規模のゲノムプロジェクトにより生体の設計図である遺伝情報が明らかになる現代において、設計図には記載されていない生体分子(タンパク質)間の情報伝達機構を明らかにすることは、重要な生命科学の研究分野と考えられています。
Project 1: CaM-kinase Cascade細胞内カルシウムイオン(Ca2+)はセカンドメッセンジャーとして、特に脳内において、神経細胞機能の最も重要な調節因子となっています。細胞外からの刺激に応答して濃度上昇した細胞内Ca2+は、Ca2+受容分子であるCalmodulin(CaM)と呼ばれる分子量約20kDaのタンパク質に結合し、その後Ca2+/CaM複合体は細胞内の多くのタンパク質分子と相互作用することによりそれらの機能を変化させ、細胞応答へと導きます。私たちの研究グループでは、この
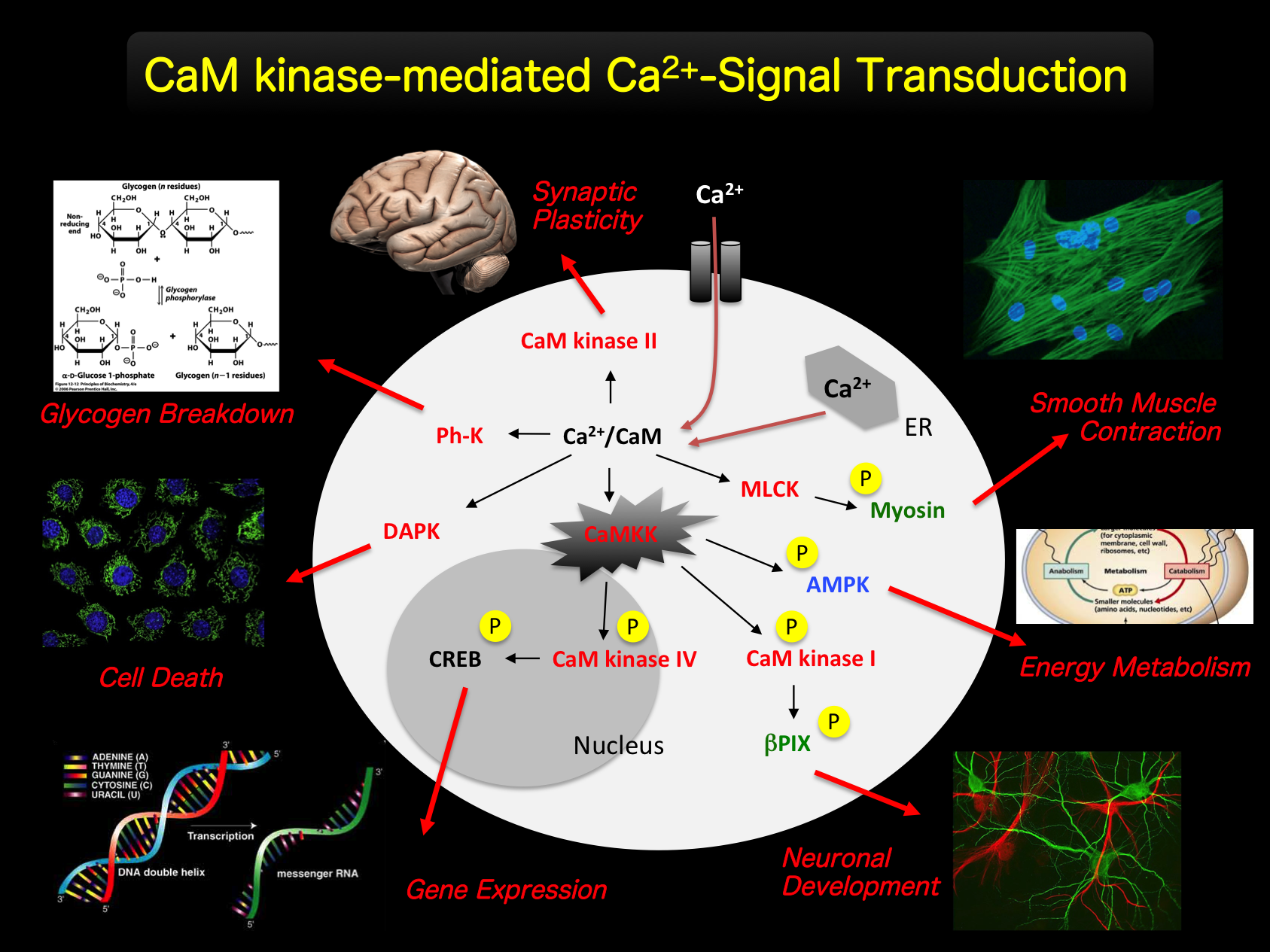 Ca2+/CaMの相互作用により活性化するタンパク質リン酸化酵素(CaMKs)の構造と生理機能調節の解明が研究プロジェックトの一つとなっています。CaMKファミリーには、平滑筋・非筋細胞の収縮反応の引き金を引くMyosin Light Chain Kinase (MLCK) やグリコーゲン代謝の律速酵素であるPhosphorylase Kinaseなどが存在しますが、その中でもCa2+/Calmodulin-dependent Protein Kinase Kinase (CaMKK)と呼ばれる酵素を中心に研究を行っています。
CaMKKは90年代半ばに旭川医科大学藤澤仁教授のグループにより脳内にその存在が示めされ(Okuno et al. J. Biochem. 1993)、その後の酵素標品の精製(Tokumitsu et al. J. Biol. Chem. 1994)とそれに引き続き行われたcDNAクローニング(Tokumitsu et al. J. Biol. Chem. 1995)により、その実体が明らかとなりました。CaMKKはその基質分子として、異なるCaMKであるCaMKIとCaMKIVの触媒領域の活性化ループ上に位置するThr残基(Thr177とThr196)をリン酸化することで、それらCaMKの酵素活性を飛躍的に増大させ、リン酸化反応の情報をさらに下流に伝搬するシグナル伝達経路を形成しています。この細胞内Ca2+を介したシグナル伝達経路はCaMキナーゼカスケードと呼ばれています。現在ではCaMKI とCaMKIV以外にも代謝調節のスーパーレギュレーターといわれる5’-AMP activated Protein Kinase (AMPK)の直接の活性化リン酸化酵素として、CaMKKの新しい生理機能調節が明らかとなり、注目されています。
このようなタンパク質リン酸化酵素によるカスケード反応、すなわちタンパク質リン酸化酵素Xがタンパク質リン酸化酵素Yをリン酸化し活性化することで、さらにYは標的基質分子をリン酸化し細胞内の情報を下流に伝える生化学的反応は古くから知られています。有名なMAP-キナーゼカスケードは細胞増殖や分化といった非常に多くの重要な生理作用を調節することが多くの研究より明らかとなっています。また古典的にも、グリコーゲン代謝における中心的な代謝酵素であるGlycogen Phosphorylaseは、細胞内のセカンドメッセンジャーであるサイクリックAMPにより活性化したPKA (cAMP-dependent Protein Kinase )によりリン酸化・活性化されたPhosphorylase KinaseによるSer14のリン酸化に伴い酵素活性が上昇し、グリコーゲンからグルコース1−リン酸の加リン酸分解(遊離)を触媒します。どの生化学の教科書にも記載されている、これら一連の研究によりEd. Krebs博士は1992年のノーベル生理学・医学賞をEd. Fisher博士とともに受賞しています。余談ですが、CaMKKの分子同定に従事していた当時の私のMentorであったTom Soderling博士はKrebs先生が主催されていたU.W.(University of Washington)の生化学研究室の大学院生としてPKA/Phosphorylase Kinase研究に従事し、学位を取得したことは後に知ることとなりました。
Ca2+/CaMの相互作用により活性化するタンパク質リン酸化酵素(CaMKs)の構造と生理機能調節の解明が研究プロジェックトの一つとなっています。CaMKファミリーには、平滑筋・非筋細胞の収縮反応の引き金を引くMyosin Light Chain Kinase (MLCK) やグリコーゲン代謝の律速酵素であるPhosphorylase Kinaseなどが存在しますが、その中でもCa2+/Calmodulin-dependent Protein Kinase Kinase (CaMKK)と呼ばれる酵素を中心に研究を行っています。
CaMKKは90年代半ばに旭川医科大学藤澤仁教授のグループにより脳内にその存在が示めされ(Okuno et al. J. Biochem. 1993)、その後の酵素標品の精製(Tokumitsu et al. J. Biol. Chem. 1994)とそれに引き続き行われたcDNAクローニング(Tokumitsu et al. J. Biol. Chem. 1995)により、その実体が明らかとなりました。CaMKKはその基質分子として、異なるCaMKであるCaMKIとCaMKIVの触媒領域の活性化ループ上に位置するThr残基(Thr177とThr196)をリン酸化することで、それらCaMKの酵素活性を飛躍的に増大させ、リン酸化反応の情報をさらに下流に伝搬するシグナル伝達経路を形成しています。この細胞内Ca2+を介したシグナル伝達経路はCaMキナーゼカスケードと呼ばれています。現在ではCaMKI とCaMKIV以外にも代謝調節のスーパーレギュレーターといわれる5’-AMP activated Protein Kinase (AMPK)の直接の活性化リン酸化酵素として、CaMKKの新しい生理機能調節が明らかとなり、注目されています。
このようなタンパク質リン酸化酵素によるカスケード反応、すなわちタンパク質リン酸化酵素Xがタンパク質リン酸化酵素Yをリン酸化し活性化することで、さらにYは標的基質分子をリン酸化し細胞内の情報を下流に伝える生化学的反応は古くから知られています。有名なMAP-キナーゼカスケードは細胞増殖や分化といった非常に多くの重要な生理作用を調節することが多くの研究より明らかとなっています。また古典的にも、グリコーゲン代謝における中心的な代謝酵素であるGlycogen Phosphorylaseは、細胞内のセカンドメッセンジャーであるサイクリックAMPにより活性化したPKA (cAMP-dependent Protein Kinase )によりリン酸化・活性化されたPhosphorylase KinaseによるSer14のリン酸化に伴い酵素活性が上昇し、グリコーゲンからグルコース1−リン酸の加リン酸分解(遊離)を触媒します。どの生化学の教科書にも記載されている、これら一連の研究によりEd. Krebs博士は1992年のノーベル生理学・医学賞をEd. Fisher博士とともに受賞しています。余談ですが、CaMKKの分子同定に従事していた当時の私のMentorであったTom Soderling博士はKrebs先生が主催されていたU.W.(University of Washington)の生化学研究室の大学院生としてPKA/Phosphorylase Kinase研究に従事し、学位を取得したことは後に知ることとなりました。
現在私たちのグループでは、CaMKKを最上流の指令リン酸化酵素として機能するリン酸化カスケード反応の詳細な動作原理を生化学的、分子生物学的、細胞生物学的手法を用いて明らかにしたいと考えています。解析対象としてCaMKKに加えて、CaMKI, CaMKIV, AMPKなどCaMKK標的リン酸化酵素群があり、これらを介した細胞内シグナル伝達機構の分子メカニズムと生理機能の解明を目指しています。
Project 2: Calmodulin-signaling細胞内カルシウムイオン(Ca2+)をセカンドメッセンジャーとするシグナル伝達機(Ca2+-Signaling)の中でもCa2+受容分子であるCalmodulin(CaM)を介した経路は多岐に渡っています。
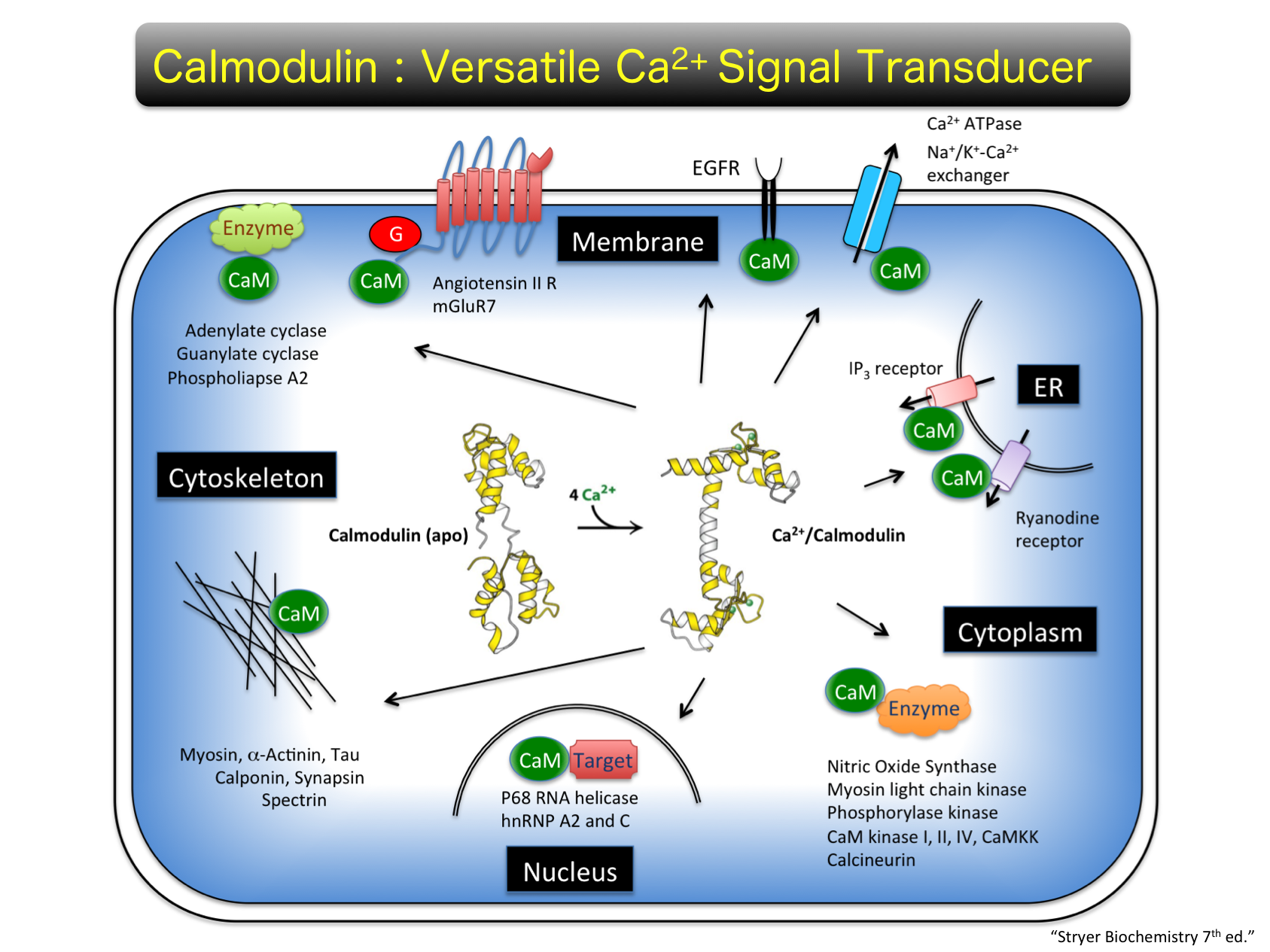 これはCaMの相互作用分子が細胞膜受容体からCaMKやNitric Oxide Synthase (NOS)に代表される酵素分子から細胞骨格分子にいたるまで、数多く存在するためです。私たちのグループでは、新たなCa2+-Signalingの経路を見出すために、Ca2+/CaM複合体の相互作用分子の網羅的同定を行ってきました。これらの研究より、新規なCaM標的分子としてWolfram症候群の原因遺伝子であるWFS-1の翻訳産物であるWolframin (Yurimoto et al. Biochemistry 2008)や樹状突起に特異的なPRG-1 (Tokumitsu et al. Biochem. J. 2010)などの同定に成功しています。しかし、標的分子の部分精製を必要とするプロテオミクス手法は、その同定の是非が組織中の発現の有無や分子含有量に依存します。そこで、私たちはセルフリーサイエンス社との共同研究により、コムギ胚芽無細胞合成系を用いて合成した2万種類弱のヒト遺伝子産物を搭載したProtein Array (Protein Active Array®)を用いることで、Ca2+/CaM複合体の相互作用スクリーニング法を開発しました。このインターラクトーム解析により、新規なCaM標的分子として筋肉特異的発現分子であるStriated Muscle Activator of Rho Signaling (STARS)を同定し、機能解析を行っています (Furuya et al. Cell Calcium 2016)。現在では、同定された新規CaM標的分子群の個別解析により、新しいCa2+-Signalingを見出すことが研究プロジェックトの一つとなっています。本インターラクトーム解析手法は分子間相互作用を基本とするシグナル伝達系の網羅解析において有効であることが明らかとなったため、他の結合リガンド分子を用いた相互作用スクリーニングも行っており、新たなシグナル伝達経路の発見が期待できます。
Project 3: Development of Protein Kinase Inhibitor
これはCaMの相互作用分子が細胞膜受容体からCaMKやNitric Oxide Synthase (NOS)に代表される酵素分子から細胞骨格分子にいたるまで、数多く存在するためです。私たちのグループでは、新たなCa2+-Signalingの経路を見出すために、Ca2+/CaM複合体の相互作用分子の網羅的同定を行ってきました。これらの研究より、新規なCaM標的分子としてWolfram症候群の原因遺伝子であるWFS-1の翻訳産物であるWolframin (Yurimoto et al. Biochemistry 2008)や樹状突起に特異的なPRG-1 (Tokumitsu et al. Biochem. J. 2010)などの同定に成功しています。しかし、標的分子の部分精製を必要とするプロテオミクス手法は、その同定の是非が組織中の発現の有無や分子含有量に依存します。そこで、私たちはセルフリーサイエンス社との共同研究により、コムギ胚芽無細胞合成系を用いて合成した2万種類弱のヒト遺伝子産物を搭載したProtein Array (Protein Active Array®)を用いることで、Ca2+/CaM複合体の相互作用スクリーニング法を開発しました。このインターラクトーム解析により、新規なCaM標的分子として筋肉特異的発現分子であるStriated Muscle Activator of Rho Signaling (STARS)を同定し、機能解析を行っています (Furuya et al. Cell Calcium 2016)。現在では、同定された新規CaM標的分子群の個別解析により、新しいCa2+-Signalingを見出すことが研究プロジェックトの一つとなっています。本インターラクトーム解析手法は分子間相互作用を基本とするシグナル伝達系の網羅解析において有効であることが明らかとなったため、他の結合リガンド分子を用いた相互作用スクリーニングも行っており、新たなシグナル伝達経路の発見が期待できます。
Project 3: Development of Protein Kinase Inhibitorタンパク質リン酸化酵素を介したシグナル伝達研究において、ターゲットとするリン酸化酵素の生理機能を解明することは最も重要な研究課題のひとつです。現在では、この生理機能解析の方法論も遺伝子改変動物やRNA干渉など多岐に渡っていますが、低分子量の酵素阻害剤を用いた機能制御研究はいまだによく用いられる手法です。またこれは、基礎的な生命科学研究を疾患研究へとつなげる重要な研究となる可能性を秘めています。これまでに、細胞内カルシウムシグナル伝達経路を標的とした分子標的創薬研究として、中枢神経系に豊富に存在する多機能性カルモデュリン依存性タンパク質リン酸化酵素II (CaMK II)の特異的阻害剤(KN-62;1-[N,O-bis(5-isoquinolinesulfonyl)-N-methyl-L-tyrosyl]-4-phenylpiperazine)の開発を世界に先駆けて行い、本酵素の生理機能解明に大きく貢献するとともに、低分子化合物を用いた細胞内情報伝達機構の生理機能解析への有用性が示されました。この経験に基づき、2002年、CaM-kinaseを介したカスケード反応の広範な機能解析を行うために、CaMKK特異的阻害剤(STO-609;7H-benzimidazo[2,1-a]benz[de]isoquinoline-7-one-3-carboxylic acid)を世界で初めて開発することに成功しました。本阻害剤も市販化され(Merck-Chemicals,Sigma-Aldrich)、世界中の研究者に使用されることが可能となり、CaM-キナーゼカスケード
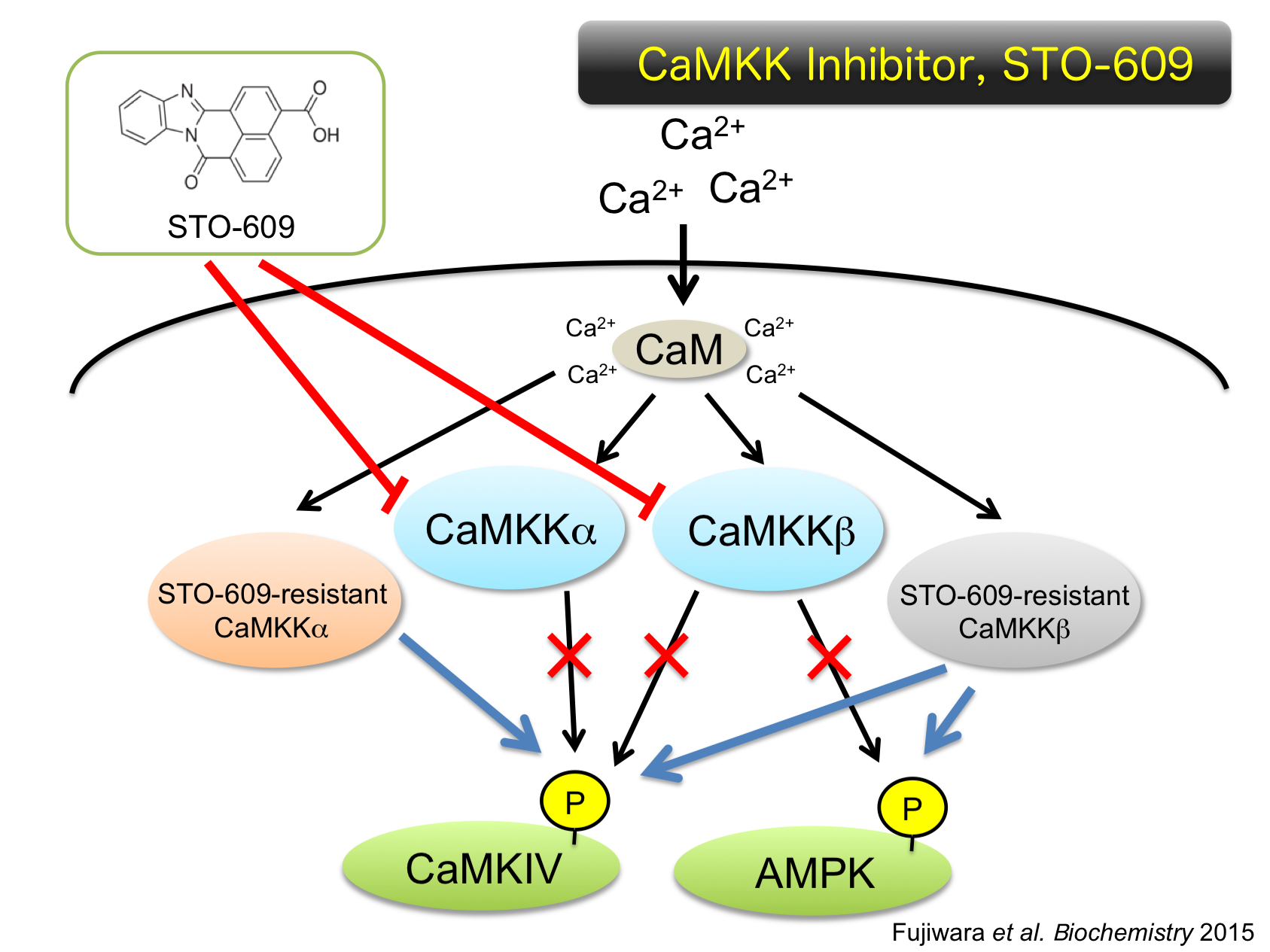 反応の幅広い生理機能の解明に結びついています。 多くの酵素阻害剤が開発され使用される一方で、阻害剤を用いた研究データの判断に疑問が生じるケースが多々見受けられます。すなわち、酵素阻害剤による生理機能制御の結果のみから、薬物のoff-target効果を考慮にいれず、標的酵素と生理機能を関係づけてしまうことです。これは、私たちの開発したリン酸化酵素阻害剤にも言えることであることから、私たちのグループでは逆に酵素阻害剤の細胞における効果が、on-targetであるのかoff-targetであるのかを再検証できる細胞システムを独自に開発したCaMKK特異的阻害剤STO-609を用いて作成しました。培養細胞に遺伝子改変したSTO-609抵抗性CaMKK変異体をもたせることで、STO-609による細胞の形質変化がこれらの変異体酵素を発現させた細胞で観察できなければ、形質変化とCaMKKシグナル伝達を結びつけることができることになります。逆に、STO-609抵抗性CaMKK変異体の発現株においてもSTO-609における効果が見られる場合は、薬物によるoff-target効果と結論づけられます (Fujiwara et al. Biochemistry 2015)。現在では、これらの細胞株を用いてoff-target効果を排除したSTO-609 を用いたCaM-キナーゼカスケード反応の生理機能解析を行うとともに新たなリン酸化酵素阻害剤の開発も進めたいと考えています。
反応の幅広い生理機能の解明に結びついています。 多くの酵素阻害剤が開発され使用される一方で、阻害剤を用いた研究データの判断に疑問が生じるケースが多々見受けられます。すなわち、酵素阻害剤による生理機能制御の結果のみから、薬物のoff-target効果を考慮にいれず、標的酵素と生理機能を関係づけてしまうことです。これは、私たちの開発したリン酸化酵素阻害剤にも言えることであることから、私たちのグループでは逆に酵素阻害剤の細胞における効果が、on-targetであるのかoff-targetであるのかを再検証できる細胞システムを独自に開発したCaMKK特異的阻害剤STO-609を用いて作成しました。培養細胞に遺伝子改変したSTO-609抵抗性CaMKK変異体をもたせることで、STO-609による細胞の形質変化がこれらの変異体酵素を発現させた細胞で観察できなければ、形質変化とCaMKKシグナル伝達を結びつけることができることになります。逆に、STO-609抵抗性CaMKK変異体の発現株においてもSTO-609における効果が見られる場合は、薬物によるoff-target効果と結論づけられます (Fujiwara et al. Biochemistry 2015)。現在では、これらの細胞株を用いてoff-target効果を排除したSTO-609 を用いたCaM-キナーゼカスケード反応の生理機能解析を行うとともに新たなリン酸化酵素阻害剤の開発も進めたいと考えています。
-
Background
免疫系は、生体内に侵入した病原体や生体内で発生したがん細胞など、非自己物質を排除するシステムです。この免疫システムの中に重要な働きを持つ分子が抗体です。抗体は、リンパ球の一種であるB細胞から産生される液性免疫応答に中心的な役割を担う分子で、病原体に直接結合することでそれらの排除に貢献しています。
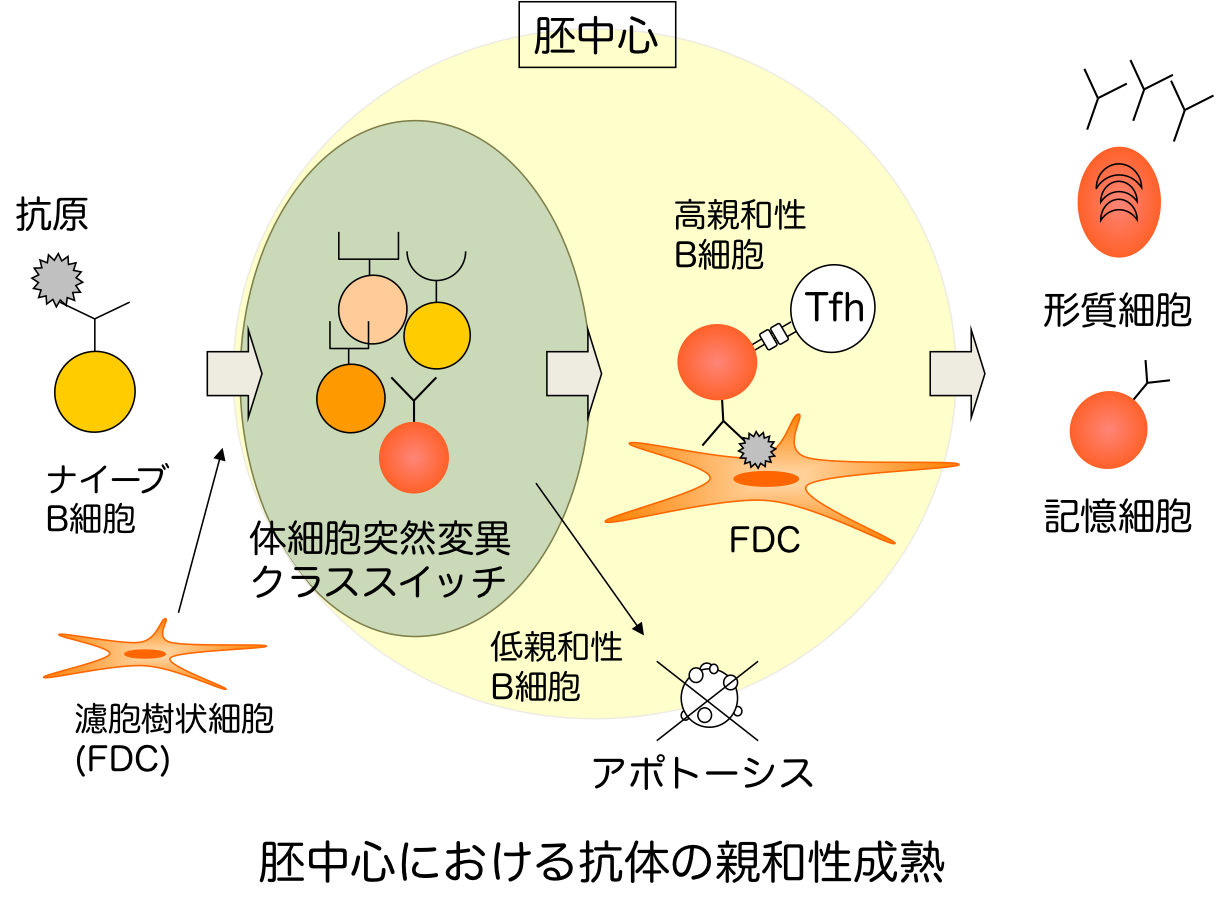 骨髄から生成されたB細胞は、全身を循環し抗原の侵入に備えています。その中で、抗原からの刺激を受けたB細胞は、リンパ組織に濾胞樹状細胞(FDC)や濾胞ヘルパーT細胞(Tfh)とともに胚中心と呼ばれる微小構造を形成します。胚中心においてB細胞は、体細胞高頻度突然変異(SHM)やクラススイッチ(CSR)より自身の抗体分子を多様化します。その後、抗原に対して高親和性抗体を産生するB細胞のみが生存し抗体産生細胞へと分化することで、効率的な免疫反応を担っています(抗体の親和性成熟)。また、二次免疫応答で活躍する記憶B細胞も胚中心から発生することが知られています。これまでに、抗体の親和性成熟や記憶応答などの現象は良く知られていますが、胚中心反応の制御機構については不明な点が多くあります。私たちのグループでは、in vitroでの細胞培養技術を基盤とし、胚中心反応の解明にアプローチしています。Project 1: FDCによる胚中心B細胞選択機構の解明
骨髄から生成されたB細胞は、全身を循環し抗原の侵入に備えています。その中で、抗原からの刺激を受けたB細胞は、リンパ組織に濾胞樹状細胞(FDC)や濾胞ヘルパーT細胞(Tfh)とともに胚中心と呼ばれる微小構造を形成します。胚中心においてB細胞は、体細胞高頻度突然変異(SHM)やクラススイッチ(CSR)より自身の抗体分子を多様化します。その後、抗原に対して高親和性抗体を産生するB細胞のみが生存し抗体産生細胞へと分化することで、効率的な免疫反応を担っています(抗体の親和性成熟)。また、二次免疫応答で活躍する記憶B細胞も胚中心から発生することが知られています。これまでに、抗体の親和性成熟や記憶応答などの現象は良く知られていますが、胚中心反応の制御機構については不明な点が多くあります。私たちのグループでは、in vitroでの細胞培養技術を基盤とし、胚中心反応の解明にアプローチしています。Project 1: FDCによる胚中心B細胞選択機構の解明胚中心でのB細胞分化には、FDCやTfhとの相互作用が必要です。中でもFDCは胚中心の形成・維持から高親和性B細胞の分化に至る一連の胚中心反応に必須であるとされています。そこで、私たちのグループでは、胚中心反応の制御に中心的な役割を担うFDCの機能解析を目的とし、
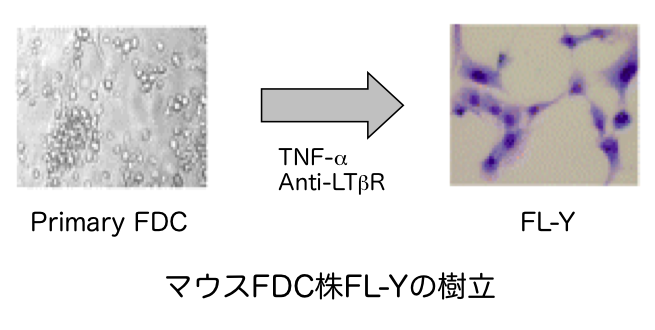 免疫したマウスからFDC株(FL-Y)を樹立しました(J. Immunol. 2006)。FL-Yは、胚中心反応をin vitroで解析するために、有用なツールとなっています。実際に、FDCから産生されるProstaglandin E2とTfhから産生されるIL-21が低親和性B細胞のNegative selectionに関与することを発見しました(J. Immunol. 2011)。現在、FL-Yと活性化B細胞との細胞培養系を用いて、胚中心における高親和性B細胞の選択機構の全容を明らかにすることを目的として研究を行っています。Project 2: FDC依存的に発生する新規単球系細胞の解析
免疫したマウスからFDC株(FL-Y)を樹立しました(J. Immunol. 2006)。FL-Yは、胚中心反応をin vitroで解析するために、有用なツールとなっています。実際に、FDCから産生されるProstaglandin E2とTfhから産生されるIL-21が低親和性B細胞のNegative selectionに関与することを発見しました(J. Immunol. 2011)。現在、FL-Yと活性化B細胞との細胞培養系を用いて、胚中心における高親和性B細胞の選択機構の全容を明らかにすることを目的として研究を行っています。Project 2: FDC依存的に発生する新規単球系細胞の解析近年、FL-Yを用いたin vitro細胞培養系の解析から、胚中心B細胞を著しく活性化することのできる新規な単球系細胞(FDC-induced monocytic cell: FDMC)を発見しました(J. Leukoc. Biol. 2014)。FDCが、単球系細胞分化に関与する報告はなく、FDCの新規な機能であると考えられます。現在、FDMCの胚中心反応への関与を、in vitro、in vivoの両面から解析しています。
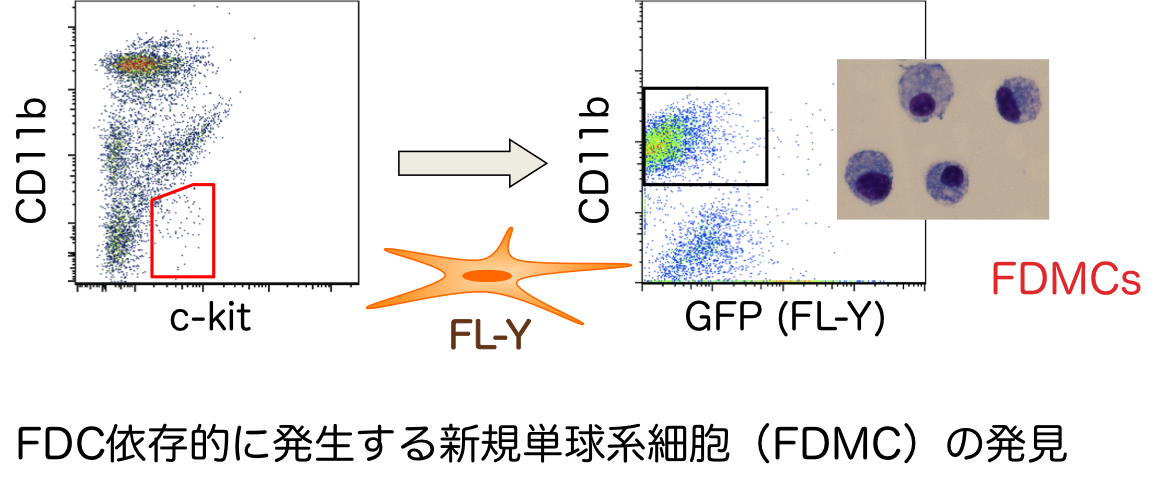 存在するCSF-1受容体に作用することが重要であることが分かりました(J. Leukoc. Bio. 2014)。しかし、CSF-1受容体に作用するもう一つのリガンドCSF-1は、FDMCの分化を誘導することができませんでした。そのため、FDMC分化においてIL-34は特異的な作用をもつと考えています。そこで、このIL-34特異的なシグナル伝達機構について研究しています。
存在するCSF-1受容体に作用することが重要であることが分かりました(J. Leukoc. Bio. 2014)。しかし、CSF-1受容体に作用するもう一つのリガンドCSF-1は、FDMCの分化を誘導することができませんでした。そのため、FDMC分化においてIL-34は特異的な作用をもつと考えています。そこで、このIL-34特異的なシグナル伝達機構について研究しています。