
研究紹介
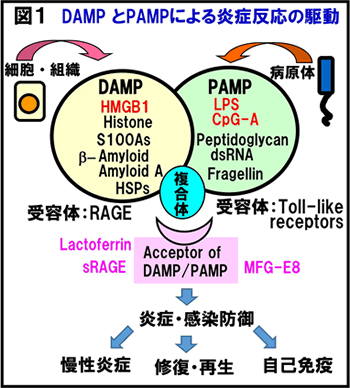
私たちの研究室では、生体外部からの病原体の浸入や種々の原因による組織損傷の結果生じる炎症反応に注目し研究してきました。特に、病原性微生物由来のPathogen-associated molecular patterns (PAMPs) と並んで自己組織由来の信号分子であるDamage-associated molecular patterns (DAMPs)によって惹起される炎症反応が、生体にとってどのような役割を果たしているかに関心を持って研究を進めてきました。図1に現在代表的なDAMP分子と考えられている因子群を列記しました。その種類は増加する一方ですが、その中でも核内クロマチン結合タンパクであるHigh mobility group box-1 (HMGB1) は、元々遺伝子転写制御、クロマチン構造維持、DNA修復など核内機能に特化した働きをすると考えられていたものが、一旦細胞外へ放出されるやサイトカイン様の作用を発揮することがわかり、大きな注目を集めるようになりました。私たちの研究室では、このHMGB1 に関する研究を以下の図1~図7に示すように進めています。
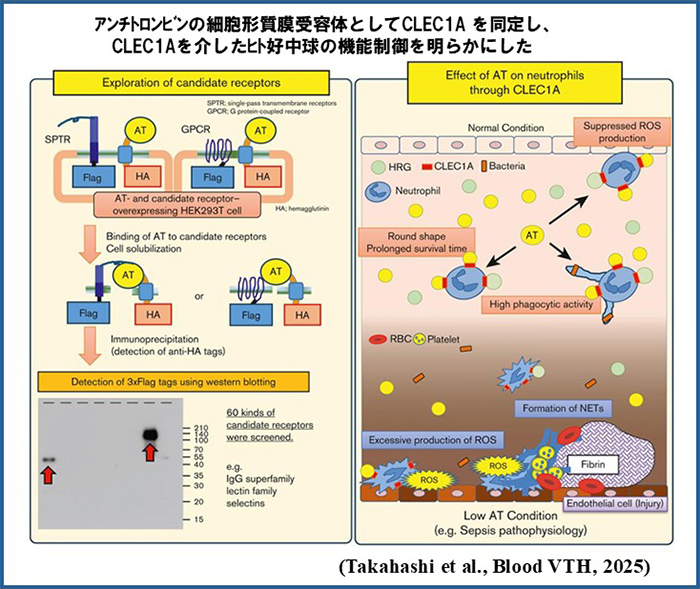
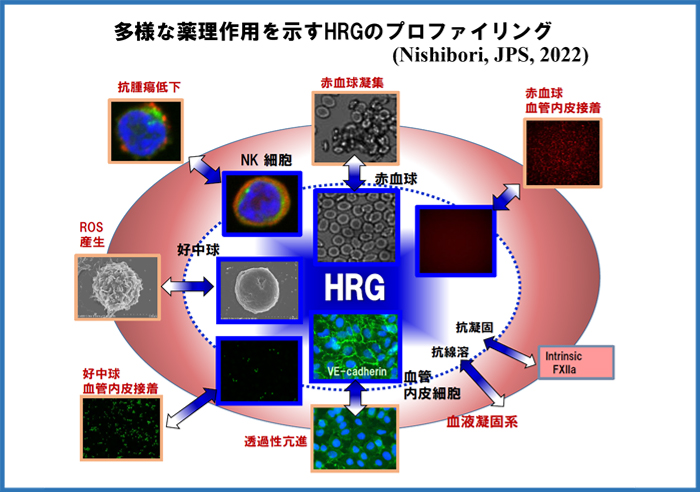
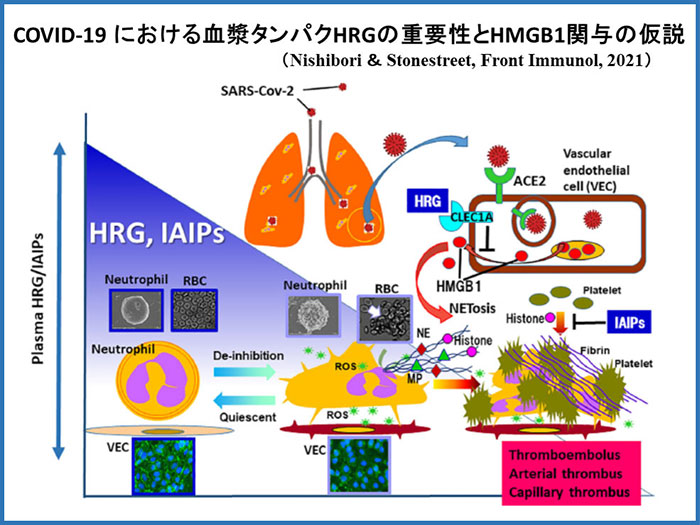
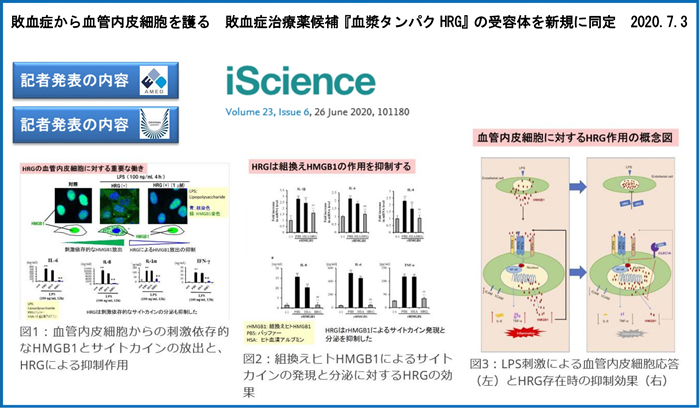
さらに、HMGB1と結合性を持ち、敗血症病態で血中レベルが著減する血漿タンパク因子Histidine-rich glycoprotein (HRG) を同定し、その血球細胞と血管内皮細胞の恒常性維持における重要な役割の解析に取り組むとともに、臨床検査法の開発や、生物製剤としての臨床応用に向けての研究を続けています。HRGに関連してプレス発表した研究内容を、上の数枚のパネルにまとめました。
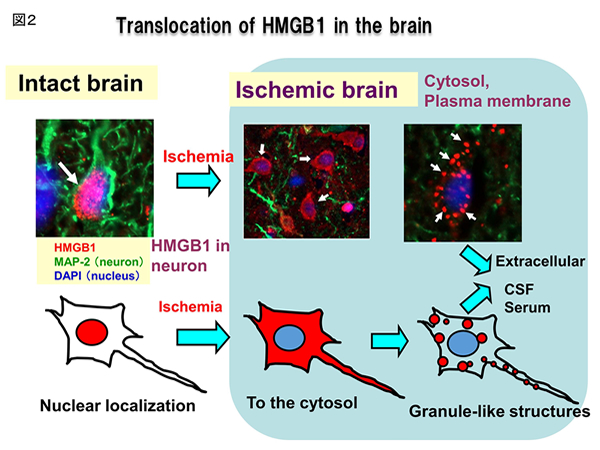
脳虚血におけるHMGB1の動態と虚血性脳障害に対する抗HMGB1抗体の効果
Wistar 系雄性ラットの中大脳動脈2時間閉塞・再灌流モデルを用いて、虚血後の血液―脳関門(血管内皮細胞の緻密結合、細胞内小器官、アストログリア細胞の終足、基底膜構造)を、透過型電子顕微鏡で観察した。アストログリア細胞の終足腫脹を定量化し、関門構造の破綻の指標とした。抗HMGB1抗体あるいは抗Keyhole limpet hemocyanin 抗体(対照抗体)を再灌流直後に静脈内投与し、血液―脳関門破綻に対する抗体効果を比較した。脳浮腫のT2強調-MRI解析では、再灌流3時間から測定を開始し、6、12、24時間,7日でMRI測定した。機能的な脳血管透過性の亢進は、尾静脈からエバンスブルーを静注し、脳内へのエバンスブルー/アルブミン複合体の漏出で評価した。アクアポリン4の発現は、免疫組織化学的に行なった。脳虚血後の神経細胞内HMGB1のトランスロケーションは、免疫蛍光二重染色法と免疫電顕の手法で解析された。その結果、神経細胞核内のHMGB1は細胞質に出た後、細胞内小器官のミトコンドリアとペルオキシゾームに局在することがわかった(図2)。この知見は、これら細胞内小器官に移行したHMGB1が低酸素ストレス下にある神経細胞の代謝の制御に関与する可能性を示唆するものである。神経細胞外に放出される途上で、これら細胞内小器官が関与することが示唆された。脳脊髄液と血漿中HMGB1の測定で、時間依存的な上昇が認められた。脳神経細胞由来のHMGB1が拡散性にこれら体液スペースに到達した可能性が示唆された。
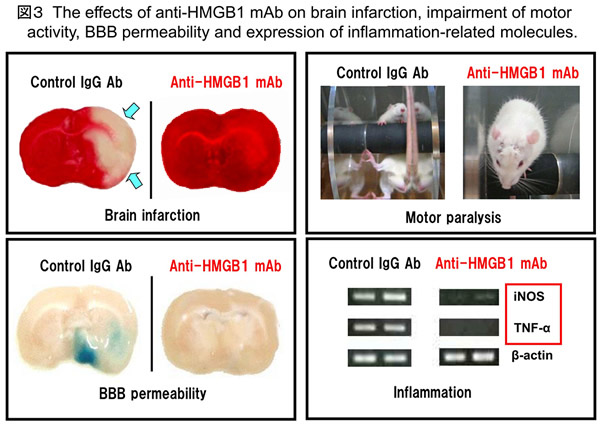
ラットMCAO2h/再灌流モデルにおいて、抗HMGB1抗体の末梢投与は脳梗塞の形成を著明に抑制することがわかった(図3)。脳虚血後の脳血管透過性の亢進メカニズムに血液脳関門の構造破綻が関与することが明らかにされた。つまり、透過型電子顕微鏡で観察すると、再灌流3時間後ですでに著明なアストログリアの突起腫脹と血管基底膜からの細胞膜解離、血管内皮細胞の形態変化などが認められた。脳血管の透過性を再灌流3-6時間で測定すると、著明に亢進していることがわかった。このように、虚血早期において血液-脳関門の透過性亢進と構造的破綻が生じていることがわかった。
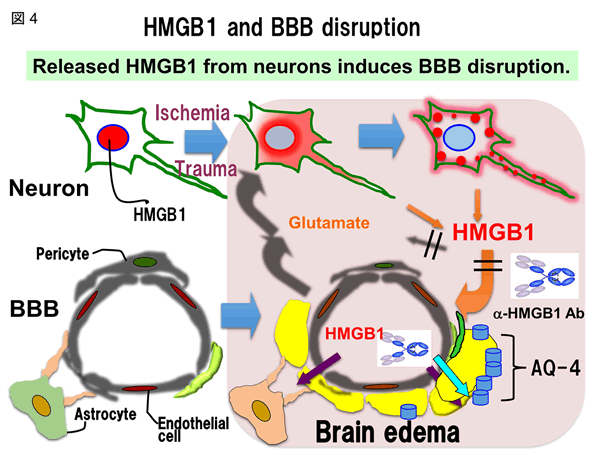
ラット脳血管内皮細胞、周皮細胞、アストロサイトからなるin vitro BBB系を用いて、組換え体HMGB1と抗HMGB1抗体のin vitro BBB系に対する直接作用を機能的ならびに形態的に評価した。その結果、組換え体HMGB1は、濃度依存的に血管内皮細胞・周皮細胞層の電気抵抗を低下させ、アルブミン漏出を促進した。抗HMGB1 抗体との前処置によって、組換え体ヒトHMGB1の活性は抑制された。3種類の細胞層のうち、組換え体HMGB1の添加によって血管内皮細胞層と周皮細胞層に収縮性の形態変化が認められたが、アストログリア細胞層には著明な変化はなかった。以上の結果から、HMGB1は血管内皮細胞と周皮細胞に直接的に作用し収縮性変化を惹起する結果、血管透過性を亢進させると推定された。
エバンスブルーの漏出抑制で示された抗HMGB1抗体のMCAOモデルでの作用は、T2-強調MRI画像でも確認された。虚血再灌流3,6,24時間後に経時的に撮像されたT2-強調MRIで、3時間後にすでにハイデンシティの脳浮腫部分が出現し、それが24時間まで拡大することがわかった。抗HMGB1抗体の投与は、脳浮腫形成を著明に抑制した。
BBBの破綻につながる要素として、BBB基底膜の消化の問題がある。基底膜の消化に関し最も重要と考えられるMMP-9/2 の活性をザイモグラフィーで検出したところ、対照群では虚血側に酵素活性の誘導が強く認められたが、抗HMGB1抗体の投与群では、低いレベルに抑制されていた。炎症関連分子群のmRNA発現も定量的PCRで解析したところ、TNF-a やiNOSなど起炎性応答に強く関与する遺伝子群の発現が抗体治療で抑制された。
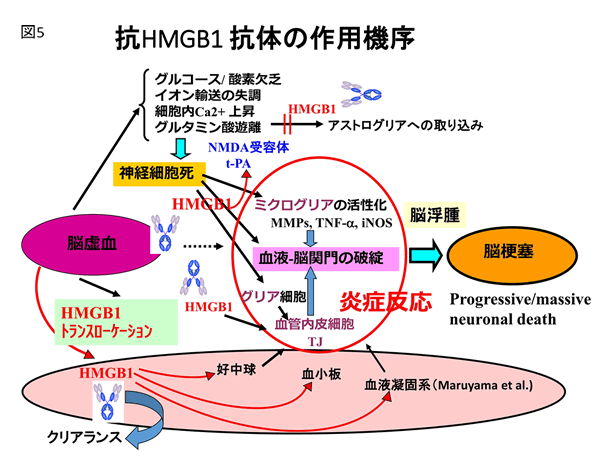
上述された抗HMGB1抗体による脳浮腫の抑制やBBB構造の維持は、ミクログリア細胞の活性化抑制を伴っており、広範囲の神経細胞が生存維持された。このことと一致して、運動麻痺の神経症状も劇的に改善された。抗HMGB1抗体の有効治療時間帯の検討で、発症後4時間まで治療が有効であることがわかった。以上の結果を総合し、抗HMGB1抗体投与は、BBBの構造と機能維持に働き、脳内炎症を抑制することによって脳梗塞を縮小できると結論した(図4、図5)。
外傷性脳障害に対する抗HMGB1抗体の効果
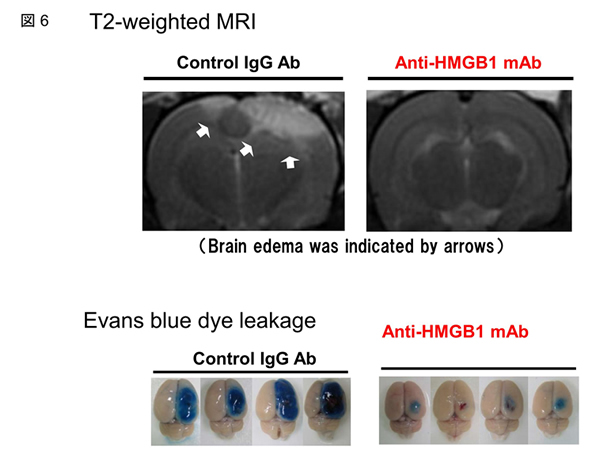
脳虚血障害と並んで脳外傷性障害では、障害部位に脳浮腫を生じる。脳浮腫形成の機序は虚血脳と同様にBBB破綻による脳血管透過性の亢進と考えることができる。つまり、脳虚血と脳外傷では一次的な障害の原因は異なっているが障害急性期の脳浮腫形成にはかなりの共通性がみられる可能性があると考えた。そこでラットのFluid percussion injury モデルを用いて先ず障害誘導後のHMGB1トランスロケーションについて検討した。非常に驚いたことに、脳外傷部位における神経細胞のHMGB1トランスロケーションは、脳虚血部位のそれと区別できないほど酷似していた。BBBの電子顕微鏡観察による形態変化も同様であった。さらに、抗HMGB1抗体の投与は、虚血障害の場合と同様にこれらの変化を劇的に抑制した。リアルタイムにMRI T2強調画像の撮影で脳浮腫部位を同定したが、MRIでも抗体の優れた効果が確認された(図6)。脳浮腫の改善と並行して、運動機能の著明な改善がRotarod と前肢壁着きの左右差評価で明らかにされた。
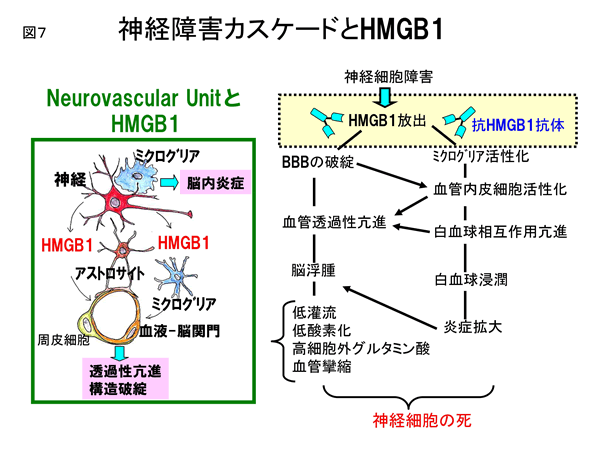
HMGB1の受容体として、これまでRAGEとToll-like receptor-4/2の存在が知られている。脳浮腫形成に関与する受容体を検討する目的でRAGE ならびにToll-like receptor-4ノックアウトマウスをそれぞれ用いて調べたところ、RAGEノックアウトマウスでは抗HMGB1抗体の効果が消失した。この実験結果から、放出されたHMGB1が作用しBBB破綻の誘導に関与する受容体は主にRAGEであると推論された。脳虚血と脳外傷に共通するBBB破綻の概念図を図4、図7に示す。
動脈硬化症に対する抗HMGB1抗体の効果
ApoE ノックアウトマウスに高脂肪食を摂食させることによってアテローム動脈硬化症モデルを作製することができる。この動脈硬化症モデルにおいて、粥状硬化症局所にHMGB1強陽性の単球・マクロファージの集積が認められる。抗HMGB1 抗体を慢性投与すると血管内皮下に侵入する単球・マクロファージ数が著明に低下するとともに、粥状硬化巣の縮小と炎症性サイトカイン類の発現低下が認められる(Arterioscler Thromb Vasc Biol, 2011)。このように粥状硬化症局所産生性のHMGB1が硬化巣拡大に働いている可能性が強く示唆され、抗HMGB1 抗体治療は血管壁の慢性炎症であるアテローム動脈硬化症を抑制できる可能性がある。
神経因性疼痛に対する抗HMGB1抗体の効果
ラットの坐骨神経部分結紮(PSNL)で神経因性疼痛モデルを作製した。過敏性疼痛の維持期に入った7日以降には、脊髄後角においてHMGB1 の上昇が認められ、その上昇はおもに2次知覚神経内で生じていると考えられた。脊髄後角では2次知覚神経周辺に活性化ミクログリアの集積が同時に観察された。これらの変化の全体が抗HMGB1 抗体の急性投与で抑制された(PLOS ONE, 2013)。したがって、PSNL神経因性疼痛モデルでは、疼痛過敏の維持期において脊髄後角2次知覚神経で持続的なHMGB1産生と放出が起こり、これが局所ミクログリアの活性化に寄与している可能性が強く示唆された。上記の神経因性疼痛モデル以外のモデルも用いて、慢性疼痛に対する抗HMGB1 抗体治療の可能性を検討している。
新しいDAMP分子とDAMP結合因子の探索・同定
これまでの研究で、代表的DAMP であるHMGB1 が極めて優れた治療標的になることがわかったので、同じグループに属する新規DAMP やDAMP結合因子を同定することが新規の創薬標的を見出す方法論になると考えた。このような考え方に基づき、タンパク結合アレイやそれから得られる情報を処理することによって、幾つかの候補分子の機能解析を進めている。


