プロジェクト
論文紹介
超音波による急性期脳梗塞の血栓溶解療法の有効性と安全性の検討
脳梗塞に対するtPAによる血栓溶解療法や血栓回収療法といった再開通療法は高い有効性が示されていますが、適応時間や出血リスク、コストなど適応に制限があり、新たな治療オプションの開発が求められています。集束超音波(FUS)手術は様々な腫瘍や頭蓋内の限局的な治療に用いられる侵襲性の低い治療法です。FUSは超音波の持つ温熱作用及び破砕作用により標的部位の組織を凝固させる。本研究では、FUSの急性期脳梗塞における血栓溶解に対する有効性と安全性をin vitro及びin vivo血栓モデルにおいて検討しました。
人工血栓を作成し、恒温槽による温熱あるいは超音波ホモジナイザー照射による重量変化を測定しました。温度上昇や超音波照射時間の増加に伴う血栓の重量減少を確認しました。次に、上記の人工血栓を血管に見立てたチューブに詰め水圧をかけることでin vitroの血栓モデルを作成し、温熱照射によって再開通が得られるまでの温度と時間を計測しました。血栓はおよそ1-3分で55℃に達し血圧(水圧)依存的に体積が縮小して遠位方向に移動することで再開通が得られました。また、安全性を評価するためにラット頸動脈に温熱あるいは超音波を照射して脳梗塞の有無または血管内皮機能について1日後と7日後に評価しました。ラット頸動脈への温熱及び超音波照射において、脳梗塞は認められませんでした。しかし、超音波照射により1日後の総頚動脈の血管内皮に機能低下を認めました。
温熱照射と超音波照射はいずれもin vitroにおいて血栓の縮小をもたらしました。動物モデルでは照射された血管内皮に一定の障害を来していましたが、照射時間を短時間にすることで低侵襲になる可能性が示されました。
- Morihara R, Yamashita T, Osakada Y, Feng T, Hu X, Fukui Y, Tadokoro K, Takemoto M, Abe K. Efficacy and safety of spot heating and ultrasound irradiation on in vitro and in vivo thrombolysis models. J Cereb Blood Flow Metab. 2022, 8:271678X221079127.
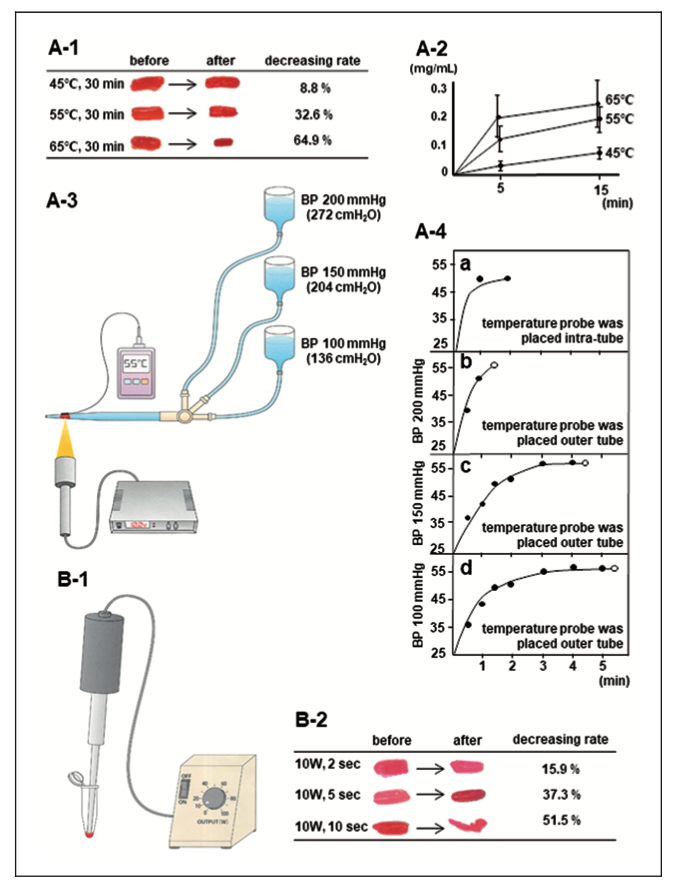
温熱もしくは超音波照射により人工血栓の重量は減少しました。
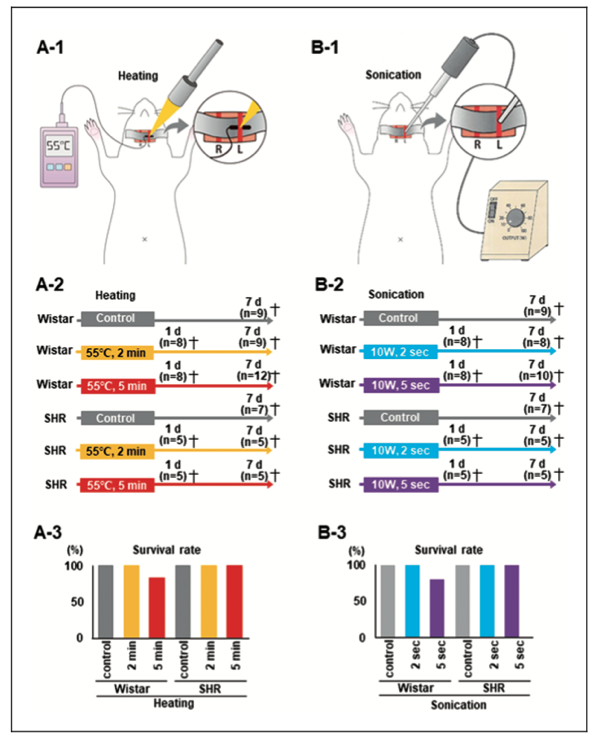
安全性評価のためラット総頸動脈に温熱あるいは超音波を照射しました。血管内皮に一定の障害を来しましたが照射時間の短縮で改善されることがわかりました。
脳梗塞脳内グリア細胞を用いた神経細胞の誘導
脳梗塞は、脳血管の閉塞により脳血流が途絶して神経細胞が死滅する疾患です。発症直後に閉塞した血管を再開通させる治療法は、近年目覚ましく発達してきました。しかしながら一旦脳梗塞が起こり、神経細胞が死滅してしまうと根本的治療法がないのが現状です。このことが現在寝たきり患者の大きな原因にもなっていることから、脳梗塞慢性期患者の機能回復を目的とした神経再生医療の開発が強く求められています。そこで本研究では、脳梗塞モデルマウスにiPS 細胞で注目されたリプログラミング技術を応用し、神経細胞に強く発現している転写因子であるAscl1, Sox2, NeuroD1をレトロウイルスベクターによりグリア細胞に発現させることで神経系細胞の誘導を目指しました。
はじめに感染細胞においてGFPを発現するレトロウイルスベクターにより、感染細胞の種類を確認しました。ウイルス注入48時間後において、GFP陽性細胞の41.9%がミクログリアマーカーIba1陽性、40.5%がアストロサイトマーカーGFAP陽性、14.5%がオリゴデンドロサイト前駆細胞マーカーPDGFRαでした。
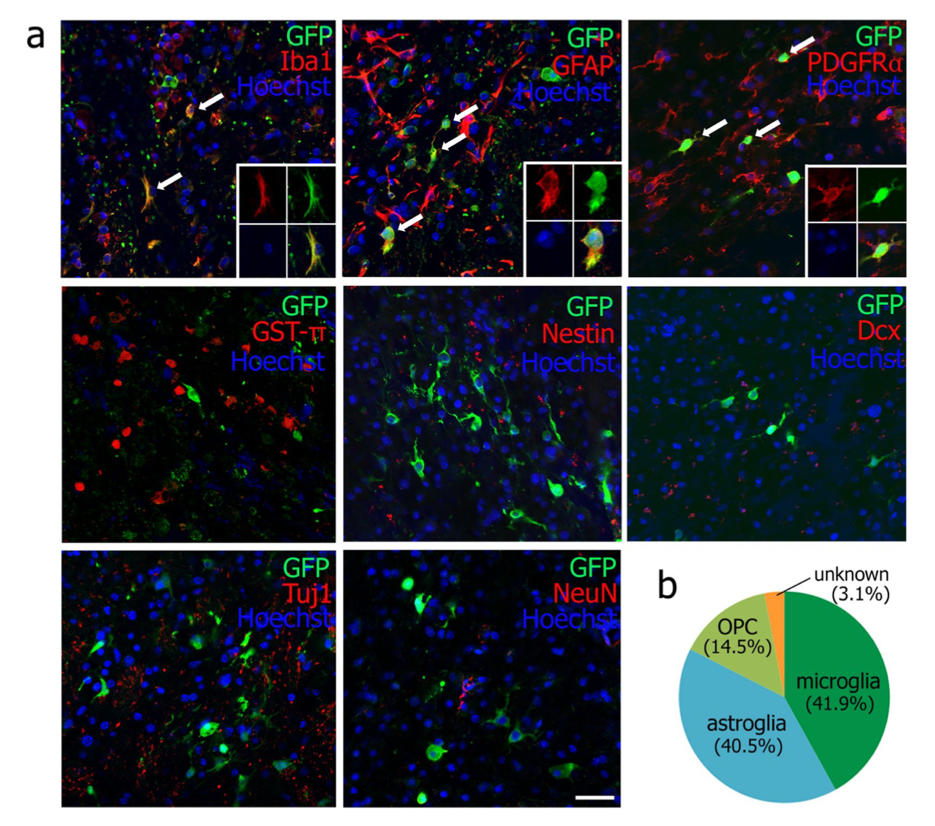
レトロウイルスベクターに感染した細胞タイプは、ミクログリア、アストログリア、オリゴデンドロサイト前駆細胞が主であり、神経系細胞マーカー陽性細胞はありませんでした。
次に一過性中大脳動脈塞栓術により脳梗塞を作成したマウスにAscl1, Sox2, NeuroD1を搭載したレトロウイルスベクターを梗塞巣周辺部に導入しました。その結果レトロウイルス注入後 24 日目にはDcx陽性神経前駆細胞が誘導され、52 日目には成熟した神経細胞(NeuN陽性)が誘導されていることが明らかになりました。
この研究成果により、脳梗塞で一旦失われてしまった神経細胞も、周囲に豊富に残っているグリア細胞から誘導し補充できる可能性が示されました。
- Yamashita T, Shang J, Nakano Y, Morihara R, Sato K, Takemoto M, Hishikawa N, Ohta Y, Abe K. In vivo direct reprogramming of glial linage to mature neurons after cerebral ischemia. Sci Rep. 2019, 29;9(1):10956.
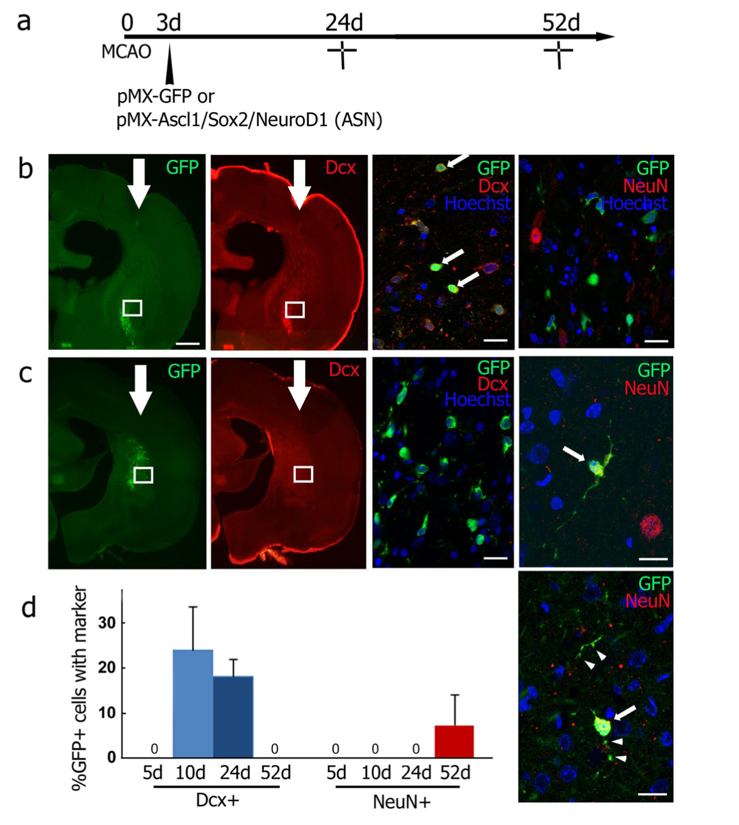
脳梗塞3日後にAscl1, Sox2, NeuroD1を搭載したレトロウイルスベクターを投与すると、24 日目にはDcx陽性神経前駆細胞が誘導され、52 日目には成熟した神経細胞(NeuN陽性)が誘導されていました。
Asidanの発見
神経難病として知られる脊髄小脳変性症に、筋萎縮性側索硬化症(ALS)に似た症状が加わる新たな疾患(脊髄小脳変性症36型、ニックネーム;Asidan)と原因遺伝子を京都大学(小泉昭夫教授)との共同研究により明らかにしました。20番染色体の上にあるNOP56という遺伝子内に存在する6塩基の繰り返し配列が約1500-2500個に異常に増えることが、本疾患の原因になることを明らかにしました。この成果はAmerican Journal of Human Geneticsに2011年に掲載されました(論文1)。 また本疾患の8家系の臨床像をまとめ、比較的純粋な小脳性運動失調に, 舌や四肢の進行性の運動ニューロン症状を呈する疾患であることをNeurologyに2012年に報告しました(論文2)。また認知機能低下、聴覚低下、嚥下障害等も起こることを次々と明らかにしこれまで報告していました(論文3-5)。 さらに、ALSモデルマウスの脊髄運動ニューロンにおいてNOP56の発現がALS発症早期に低下すること(論文6)や、患者の剖検脳・脊髄のニューロンにおいて6塩基の繰り返し配列をもつ巨大なRNAの沈着を認めることを報告しました(論文7)。 患者由来iPS細胞株が複数樹立されており、今後は神経細胞に分化させることで、詳しい病態メカニズムの解明を目指します。
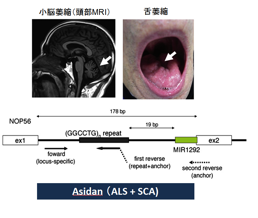
脊髄小脳変性症(脊髄小脳変性症36型;Asidan)の原因遺伝子を明らかにしました。20番染色体の上にあるNOP56という遺伝子内に存在する6塩基の繰り返し配列が約1500-2500個に異常に増えることが、本疾患の原因になることを明らかにしました。
- Manabe Y, Shiro Y, Takahashi K, Kashihara K, Abe K (2000) A case of spinocerebellar ataxia accompanied by severe involvement of the motor neuron system. Neuro Res 22:567-70.
- Ohta Y, Hayashi T, Nagai M, Okamoto M, Nagotani S, Nagano I, Ohmori N, Takehisa Y, Murakami T, Shoji M, Kamiya T, Abe K (2007) Two cases of spinocerebellar ataxia accompanied by involvement of the skeletal motor neuron system and bulbar palsy. Intern Med 46:751-5.
- Kobayashi H, Abe K, Matsuura T, Ikeda Y, Hitomi T, Akechi Y, Habu T, Liu W, Okuda H, Koizumi A (2011) Expansion of intronic GGCCTG hexanucleotide repeat in NOP56 causes SCA36, a type of spinocerebellar ataxia accompanied by motor neuron involvement. Am J Hum Genet 89:121-30.
- Ikeda Y, Ohta Y, Kobayashi H, Okamoto M, Takamatsu K, Ota T, Manabe Y, Okamoto K, Koizumi A, Abe K (2012) Clinical features of SCA36: a novel spinocerebellar ataxia with motor neuron involvement (Asidan). Neurology 79:333-41.
- Abe K, Ikeda Y, Kurata T, Ohta Y, Manabe Y, Okamoto M, Takamatsu K, Ohta T, Takao Y, Shiro Y, Shoji M, Kamiya T, Kobayashi H, Koizumi A. (2012) Cognitive and affective impairments of a novel SCA/MND crossroad mutation Asidan. Eur J Neurol 19:1070-1078.
- Ikeda Y, Ohta Y, Kurata T, Shiro Y, Takao Y, Abe K. (2012) Acoustic impairment is a distinguishable clinical feature of Asidan/SCA36. J Neurol Sci 324:109-112.
- Morimoto N, Yamashita T, Sato K, Kurata T, Ikeda Y, Kusuhara T, Murata N, Abe K. (2012) Assessment of swallowing in motor neuron disease and Asidan/SCA36 patients with new methods. J Neurol Sci 324:149-155.
- Miyazaki K, Yamashita T, Morimoto N, Sato K, Mimoto T, Kurata T, Ikeda Y, Abe K. (2013) Early and selective reduction of NOP56 (Asidan) and RNA processing proteins in the motor neuron of ALS model mice. Neurol Res 35:744-754.
- Liu W, Ikeda Y, Hishikawa N, Yamashita T, Deguchi K, Abe K. (2014) Characteristic RNA foci of the abnormal hexanucleotide GGCCUG repeat expansion in spinocerebellar ataxia type 36 (Asidan). Eur J Neurol. 21: 1377-1386.
- Ohta Y, Yamashita T, Hishikawa N, Sato K, Matsuzono K, Tsunoda K, Hatanaka N, Takemoto M, Takemi T, Takamatsu K, Abe K. (2017) Potensional multisystem degeneratoin in Asidan patients. J Neurol Sci. 373: 2016-2222.
- Matsuzono K, Imamura K, Murakami N, Tsukita K, Yamamoto T, Izumi Y, Kaji R, Ohta Y, Yamashita T, Abe K, Inoue H. (2017) Antisense Oligonucleotides Reeduce RNA Foci in Spinocerebellar Ataxia 36 Patient iPSCs. Mol Ther Nucleic Acids 15:211-219Potensional multisystem degeneratoin in Asidan patients. J Neurol Sci. 373: 211-212.
